Chiralitätsisomerie: D-L-Nomenklatur |
Seite 9/19 | |||||||||||||
|
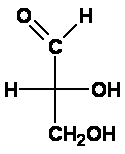
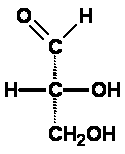
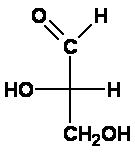
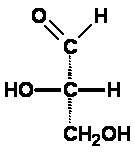
Lösung 1 des Zuordnungsproblems: Emil Fischer nahm die damals einfachste optisch aktive Verbindung, den Glycerinaldehyd (2,3-Dihydroxypropanal) und ordnete das "rechtsdrehend" völlig willkürlich derjenigen Struktur zu, bei der in der Fischer-Projektion die Hydroxylgruppe am Kohlenstoffatom C2 nach rechts zeigt. Er nannte die Verbindung "D-Glycerinaldehyd", ihr linksdrehendes Enantiomer "L-Glycerinaldehyd".
Die Buchstaben D bzw. L stammen von lat. dexter = rechts bzw. laevus = links und bezeichnen hier die Stellung der Hydroxylgruppe am Chiralitätszentrum in der Fischer-Projektion. Man erkennt: das war eine Lösung, wie sie Alexander mit dem Gordischen Knoten schon praktiziert hatte, nämlich eine rein Pragmatische. Hinweis: Ursprünglich verwendete Fischer d und l (die Kleinbuchstaben). Da diese aber auch synonym mit (+) und (-) für rechts- bzw. linksdrehend verwendet wurden und deshalb die Bezeichnungen mehr verwirrten als vereinfachten, wurden auf einen Vorschlag von Vickery (1947) und Hudson (1948) für die Konfigurationsbezeichnung nur noch die Großbuchstaben D und L verwendet. Lösung 2: Witzigerweise stellte sich viel später, bei der röntgenkristallographischen Bestimmung der absoluten Konfiguration im Jahre 1955 durch Bijvoet heraus, dass die getroffene Zuordnung D zu (+) und L zu (-) (beim Glycerinaldehyd!) wirklich die korrekte war! Das nennt man das Glück des Tüchtigen! Aber erst nach Bijvoet konnte man sicher und absolut zuordnen. |
     |
|||||||||||||
 |
||||||||||||||
| (c) Walter.Wagner ät uni-bayreuth.de, Universität Bayreuth; Impressum | ||||||||||||||