Zurück zur Gliederung. Zurück zu Schriftliche Hausarbeiten.
![]()
Ein wichtiger Schritt bei der Nitrat-Bestimmung ist dessen Umwandlung in Nitrit. Nach einer älteren Methoden geschieht dies mit Hilfe einer mit Cadmiumgranulat gefüllten Säule. Wegen der Toxizität scheidet die Anwendung dieser Methode in der Schule aus. Im gegebenen Reaktionsmedium "Wurst" besitzt alleine Cadmium ein ausreichendes Reduktionspotential, um eine vollständige Umwandlung zu gewährleisten und unerwünschte Nebenreaktionen, z.B. Reduktion von NO2- zu N2 oder NH3, zu verhindern. Somit ist ein Austausch des Cadmiums z.B. durch Zink oder Kupfer nicht möglich. Deshalb fiel die Entscheidung in dieser Arbeit zugunsten des erst 1988 von W. ARNETH und B. HEROLD[31] entwickelten Verfahrens der enzymatischen Reduktion aus.
2.3.1. Prinzip und Durchführung
Das Verfahren beruht auf der photometrischen Bestimmung eines nur durch Nitrit entstehenden Farbkomplexes. Aus durch NO2- (bzw. HNO2) diazotiertem Sulfanilamid und der Kupplungskomponente N-(1-Naphthyl)-ethylendiamin-dihydrochlorid (NED) entsteht ein roter Azofarbstoff, dessen Gehalt bei 540nm über ein Spektralphotometer bestimmt werden kann.
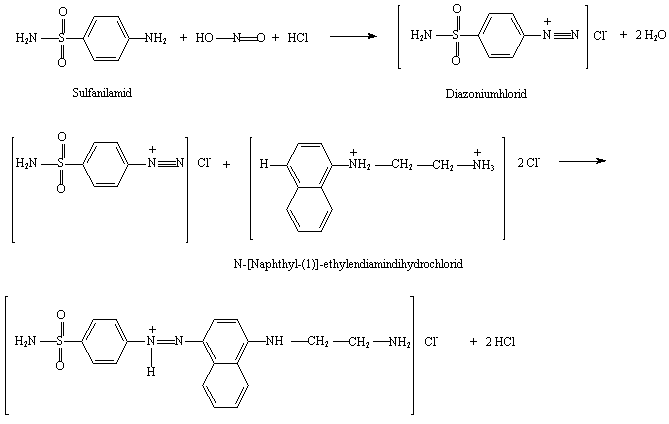
Abb. 9: Farbreaktion des Nitrits[25]
Um die Empfindlichkeit der Methode zu erhöhen, wird hier nicht mit dem sonst üblichen Grieß'schen Reagenz gearbeitet. Dadurch sinkt die Nachweisgrenze auf 50µg NO2- pro ml.
All die genannten Nachteile des Cadmiumreduktors lassen sich umgehen, indem eine Nitratreduktase eingesetzt wird. Durch präparative Isolierung (Trennung und Reinigungsschritte) gewinnt man diese aus Kulturen von Aspergillus-Stämmen. Wie viele Mikroorganismen verfügt Aspergillus sp. über ein Enzymsystem der NO3--Assimilation, wodurch über Zwischenstufen NH4+ entsteht. Der erste Schritt ist die Umwandlung in NO2-, die durch das Enzym Nitratreduktase katalysiert wird. Dieses Enzym kann isoliert und gefriergetrocknet für die Analyse eingesetzt werden. Die benötigten Elektronen werden durch beta-NADPH-Na4 in Tablettenform bereitgestellt (Abb. 10a).
Als gut wasserlösliche Verbindungen können NO2- und NO3- mit Wasser gut aus den Proben extrahiert werden, unterstützt durch einen Erhitzungsvorgang. Damit die spätere Nitrit-Farbreaktion ungestört ablaufen kann, wird vorhandenes Protein durch Carrez-Lösung I und II gefällt. Diese zwei Reagenzien bilden einen weißen voluminösen Niederschlag (Abb. 10b), der vorhandene Proteinmoleküle mitreißt.
Um das Wirkungsoptimum der Enzymaktivität zu erreichen, muss ein bestimmter pH-Bereich (pH=8-9.5) eingestellt werden. Dies erweist sich als etwas schwierig, da störende Farbeinflüsse das Auftreten des Farbumschlages des Indikators Bromthymolblau nach blau nicht deutlich erkennen lassen. Deshalb muss der pH-Wert ständig mit Hilfe von Indikatorpapier kontrolliert werden. Da überschüssige Zinkionen die Enzymaktivität stören können, ist ein Zusatz von Titriplex III notwendig. Dieses fängt Zn2+ weg, indem es einen stabilen, wasserlöslichen Chelatkomplex bildet. In der nach der Filtration erhaltenen Lösung kann also Nitrit direkt bestimmt werden. Eine Erfassung von Nitrat erfolgt nach Reduktion zu NO2- indirekt als Gesamt-NO2--NO3-. Aufgrund des sehr sensiblen Reaktionsschrittes der Nitratreduktion muss exakt und genau gearbeitet werden. Ein für die Schule vereinfachter Arbeitsablauf konnte nicht erarbeitet werden.[31] [32]
Abb. 10: Enzymatische Nitratreduktion
2.3.2. Ergebnisse
Aus den gemessenen Extinktionen der Nitritbestimmung ergeben sich mit einer zuvor erfaßten Eichgerade die Nitritwerte als Natriumnitrit in mg/kg Probe. Aus den Arbeitsschritten kann ein Fehler abgeschätzt werden, der die Angabe der Ergebnisse ohne Dezimalen bedingt. In gleicher Weise wird mittels einer Eichgeraden und deren Faktoren aus den Extinktionen der Nitratbestimmung der Gesamt-NO2--NO3--Gehalt als Kaliumnitrat in mg/kg Probe berechnet. In den Tabellen sind jeweils die aus den durchgeführten Messungen erhaltenen Mittelwerte angegeben. Um die Vorgänge des Pökelprozesses mit Hilfe der Ergebnisse näher erläutern bzw. erkennen zu können, genügen diese Werte jedoch noch nicht. Ein Umrechnen in unterschiedliche Verbindungen ist notwendig. Zusätzlich werden die Ergebnisse der Bestimmung des an Myoglobin gebundenen NO mit einbezogen. Die in Tab. 4 und im weiteren Verlauf verwendeten Abkürzungen entsprechen denen im praktischen Teil.
Proben Nr. 1 2 3 4 5 6 w2[mg NO2-/kg] 0,2 12 13 13 4 5 w9[mg NO3-/kg] 5,7 20 21 14 54 32 w4[NO2-+NO3- mg NaNO2/kg] 7 40 44 37 67 43
Tab. 4: Ergebnisse zur NO2--NO3--Bestimmung
2.3.3. Diskussion der Ergebnisse
2.3.3.1. Bedeutung der ermittelten Werte
Durch die FlV werden zwar nicht die Zugabemengen der Pökelstoffe geregelt, wohl aber werden zulässige Höchstwerte im verzehrfertigen Endprodukt festgelegt. Für die untersuchten Produkte gilt ein Wert von 100ppm an Gesamt-NO2--NO3-, berechnet als NaNO2 (Tab.1). Bei Betrachtung der hier ermittelten Werte (z.B. w4) stellt man fest, daß diese weit, bis auf P5, darunter liegen.
Obwohl die analysierten gepökelten Proben ausschließlich mit NPS hergestellt wurden, findet sich im Endprodukt dennoch Nitrat. Woher stammt dieses also? Der Nitratbildung können mehrere Ursachen zugeschrieben werden. Im Brät, welches fein zerkleinertes Fleisch enthält, liegt der Muskelfarbstoff hauptsächlich in der Form MbO2 vor. Bei Zugabe von Nitrit wird das zentrale 2-wertige Hämeisen oxidiert, es entsteht MetMb, gleichzeitig wird durch Reduktion NO gebildet, das durch vorhandenen Luftsauerstoff weiter zu Nitrat oxidiert wird. Ebenso entsteht durch die vorliegende Verwendung von L-Asc bzw. Na-L-Ascorbat vermehrt NO im Wurstgut, welches bei Anwesenheit von Sauerstoff auch zu NO3- oxidiert wird. Das in Nitrat umgewandelte Nitrit geht für die Pökelung verloren, da L-Asc aufgrund des Redoxpotentials nicht in der Lage ist, es wieder zu reduzieren. Auch eine mikrobielle oder enzymatische Umwandlung scheidet bei den analysierten Proben, zumindest nach dem Erhitzungsprozeß bei der Herstellung, aus.
Daß nicht nur über Oxidationsvorgänge NO3- entsteht, zeigt P1. Demnach gelangt Nitrat hier ausschließlich über die Rohstoffe in das Wurstgut, hauptsächlich über das zugesetzte Trinkwasser. So gelangen bei P1 durch die Schüttung 3,6mg NO3- in diese Brühwurst. In Hof z.B. enthält Trinkwasser 18mg NO3- pro Liter Wasser; bei P1 beträgt die Schüttung 20%. Dieser Wert ist somit, anhängig vom Nitratgehalt des Trinkwassers, sehr starken Schwankungen ausgesetzt. Auch über Fleisch (Schweinefleisch 1-2ppm NO2-, 5ppm NO3-) und vor allem über Blattgewürze (Petersilie 5-2000(!)ppm NO3-) gelangt Nitrat in das Erzeugnis. Dass im Brät vorhandene Mikroorganismen und/oder fleischeigene Redox- und Enzymsysteme eine geringe Aktivität der Nitratreduktion aufweisen, zeigt der bei P1 ermittelte Restnitritwert (w2=0,2ppm) sowie die Umrötung von 11% (Tab.2).
Wie die Ergebnisse zeigen, findet sich eine doch relativ große Menge des eingesetzten Nitrits unverändert wieder (w2). Trotz optimaler Technologien verbleibt also ein Teil des Pökelstoffes ungenutzt im Wurstgut. Auf die Frage nach den Gründen sind mehrere Antworten denkbar: Wegen des in der Wurst vorliegenden Reaktionsmediums ist ein so hoher Überschuss an Nitrit notwendig, damit die Pökelprozesse überhaupt in ausreichendem Ausmaß ablaufen können. Zahlreiche Untersuchungen aus der Literatur bestätigen andererseits, dass bei den heute praxisüblichen Technologien eine Verringerung des Nitritzusatzes durchaus möglich wäre, dies aber, wie Nachfragen in Handwerksbetrieben ergaben, in der Praxis, zur Sicherheit der Produktion nicht umgesetzt wird.
Diejenige Bedingung, welche einen erheblichen Einfluss auf die Umrötung besitzt, ist der vorliegende pH-Wert. Je niedriger dieser ist, desto effektiver verläuft der spontane Nitritzerfall. Da in der Rohwurst ein im Vergleich zur Brühwurst saureres Milieu vorliegt, kann also mehr NO2- abgebaut werden (auch Mikroorganismen könnten dabei mitwirken oder die längere Lagerzeit). Durch den vermehrten NO2--Abbau entsteht aber auch vermehrt NO3- durch Oxidationsvorgänge von überschüssigem NO, was bei P6 auch festgestellt wurde (w9(P6)=32ppm, w9(P3)=21ppm).
Auf den ersten Blick erstaunen die Ergebnisse der P5. Auch Literaturwerte (Tab.5) zeigen diese Tendenz. Die sehr hohen Restnitratwerte haben ihre Ursache möglicherweise in den in der Leber enthaltenen Enzymen und im Blutgehalt, was spezifische Reaktionsbedingungen schafft.
An dieser Stelle muss allerdings betont werden, dass die in dieser Arbeit untersuchten Proben keinesfalls repräsentative Ergebnisse liefern können. Ein freundlicherweise gewährter Einblick in eine interne Untersuchungsreihe der BAFF ermöglichte aber eine vergleichende Betrachtung der Werte. Die in dieser Arbeit erhaltenen Zahlen stehen damit tendenziell in guter Übereinstimmung. Was sich hier schon angedeutet hat, bestätigt sich durch die Untersuchungsreihe der BAFF. Während die Restnitrit und -nitrat-Werte nicht nur zwischen den Produktgruppen sondern auch innerhalb dieser stark schwanken, so liegt doch gute Übereinstimmung bei den jeweiligen Wurstsorten vor.
Tab. 5: Literaturwerte zum Gesamtnitrit/nitrat-Gehalt einiger Wurstsorten[33]
Dies alles zeigt, dass der Nitritverbrauch bzw. Restgehalt von der thermischen Belastung, den chemischen, enzymatischen und mikrobiellen Vorgängen während der Herstellung und Lagerung, dem pH-Wert wie auch von der Rezeptur beeinflusst wird.[17] [34]
2.3.3.2. Verbleib des eingesetzten Nitrits - Bilanzanalyse
Proben Nr. 2 3 4 5 6 w10[mgNO2-/kg] 53 43 43 30 67 w11[mgNO2-/kg] 21 21 16 36 29 w6 [mgNO2-/kg] 5 2 2 5 5 w12[mgNO2-/kg] 27 20 25 -11 38
Tab. 6: Bilanzanalyse, mit w10 = durch NPS eingesetztes Nitrit, w11 = Gesamt-NO2--NO3- als Nitrit, w6 = an NOMb gebundenes "Nitrit", w12 = nicht erfaßbares Nitrit
Abb. 11: Bilanzanalyse - Säulendiagramm (nicht enthalten)
Zu bemerken sind vor allem die geringen Mengen an NO2-, die letztlich - umgewandelt in NO - an NOMb gebunden werden. Wenn nun die Summe gebildet wird aus NO-, welches, umgewandelt in NO, an Mb gebunden ist (w6), dem vorhandenen Restnitrit (w2), sowie dem in Nitrat umgewandelten Nitrit (abzüglich dem Nitrat, welches durch Rohstoffe zugesetzt wird, w11), so stellt man fest, dass dieser Wert sich erheblich von dem des zugesetzten Nitrits (w10) unterscheidet. Also muß ein Teil des Pökelstoffes mit den Inhaltsstoffen der Wurstmasse Reaktionen eingegangen sein, so dass dieser mit den angewendeten Methoden nicht erfasst werden kann (w12). Als Beispiel sei P3 genannt. Während 43ppm (=100%) NO2- eingesetzt werden, werden nur 23 ppm (=56%) (w6 + w11) wieder erfasst. 20ppm (=46%) können also nicht mehr bestimmt werden. Wo verbleibt nun dieses restliche Nitrit?
Es stehen mehrere Reaktionspartner zur Verfügung, wobei hier nur eine kurze Zusammenfassung gegeben werden kann. Vor allem die Seitengruppen von vorhandenen Peptidketten stehen zur Verfügung, mit denen 20-30% des eingesetzten Nitrits reagieren. Darauf werden nicht nur die Texturveränderungen gepökelter Produkte zurückgeführt, sondern auch das Pökelaroma. Dieses ist ein komplexes Gemisch aus Reaktionsprodukten von Geruchs- und Geschmacksstoffen des Fleisches sowie deren Vorstufen. Die verantwortlichen Verbindungen sind bis heute (August 1995) noch nicht alle bekannt (z.B. besitzen erhitzte gepökelte Produkte wiederum ein anderes Aroma wie nicht erhitzte).
Eine mengenmäßig untergeordnete Rolle dürften die folgenden Reaktionswege des Pökelstoffes spielen, denn dafür kommen insgesamt weniger als 15% des zugesetzten Nitrits in Frage:
| Während der Produktion entweicht wohl ein Teil (1-5%) als gasförmige Verbindungen wie N2O, NO, NO2, N2O3. Deshalb darf L-Asc nie in direkten Kontakt mit NPS gelangen, da sofort braune Dämpfe (NO) entweichen. | |
| Auch ungesättigte Fettsäuren bieten einen möglichen Reaktionspartner. | |
| Bei der Berechnung des an NOMb gebundenen Nitrits geht man davon aus, dass jeweils ein Molekül NO sich an ein Molekül Mb bindet. Durch Denaturierung und Abspaltung des Proteinanteils kann jedoch ein zweites Molekül NO gebunden werden, was den Nitritverbrauch dafür verdoppeln würde. | |
| Ein der Menge nach zu vernachlässigender Anteil von Molekülformen des NO2- reagiert mit sekundären Aminen zu Nitrosierungsprodukten (Werte weit unter 1 mg/kg), denen aber kanzerogene und mutagene Wirkung zugeschrieben wird. Die keimhemmende Wirkung geht sicherlich auch von Reaktionsprodukten des Nitrits aus. So wird u.a. das Wachstum von gramnegativen (z.B. Salmonellen) und von sporenbildenden (z.B. Clostridium botolinum) Mikroorganismen eingeschränkt. Nach dem Entdecker wird diese Wirkung unter der Bezeichnung Perigo-Faktor zusammengefasst. |
All dies macht allgemein gültige Aussagen mit Mengenangaben über den Pökelprozeß nicht möglich. Zu viele unvorhersagbare und schwankende Faktoren beeinflussen das Ausmaß des Nitrit-Verbrauchs.[20] [35] [36]
Zusammenfassend ergibt sich ein für den Pökelprozeß anwendbares Schema über den Verbleib zugesetzten Nitrits. Als Mittelwert ergab sich ein Anteil von 48% des eingesetzten Nitrits als erfaßbar. Auch die übrigen %-Werte wurden jeweils als Mittelwert der untersuchten Proben errechnet. Die %-Angaben des nicht erfaßbaren Nitrits wurden aus der Literatur [20] übernommen.
Abb. 12: Verbleib des zugesetzten Nitrits
![]()
Zurück zur Hompage Didaktik der Chemie . Zurück zur Hompage Universität Bayreuth .
Mail an: Walter.Wagner ät uni-bayreuth.de