Lösung:
Sieht Ihr Graph auch so aus?
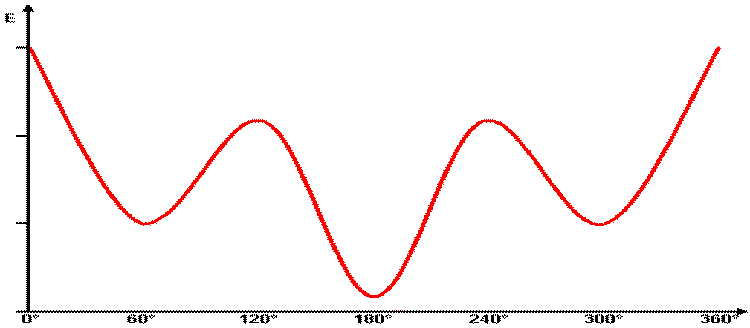
Er zeigt die Energie im
Butanmolekül bei der Rotation um die C2-C3-Bindung an.
 |
 |
 |
 |
 |
 |
 |
| 0° |
60° |
120° |
180° |
240° |
300° |
360°=0° |
| (voll)ekliptisch |
(schief-)gestaffelt |
(partiell)ekliptisch |
gestaffelt |
(partiell)ekliptisch |
(schief-)gestaffelt |
(voll)ekliptisch |
| |
(gauche) |
|
(anti) |
|
(gauche) |
|
| Maximum |
Zwischen-minimum |
Zwischen-maximum |
Minimum |
Zwischen-maximum |
Zwischen-minimum |
Maximum |
-
Beim Torsionswinkel 0° findet man 1 absolutes Maximum bei
ekliptischer Konformation.
-
Bei den Torsionswinkeln 60° und 300° findet man insgesamt
2 Zwischenminima: gestaffelte Konformationen; um diese von der bei 180° zu
unterscheiden, nennt man sie "gauche".
-
Bei den Torsionswinkeln 120° und 240° findet man
insgesamt 2 Zwischenmaxima:
ekliptische Konformere.
-
Beim Torsionswinkel 180° findet man 1 absolutes Minimum
bei günstigster gestaffelter
Konformation; um diese von der bei 60 und 300° zu unterscheiden, nennt man
sie "anti".
Nun können wir die Frage nach
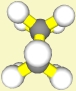
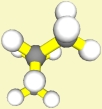
der Amplitude beantworten: Die Größe (Sperrigkeit) der Reste der an der Rotation um die C-C-Bindung
beteiligten C-Atome ist ausschlaggebend. Bei Ethan sind es lauter gleiche,
kleine H-Atome, bei Butan
kommt eine größere Methylgruppe vor; dadurch ist auch die abstoßende Wirkung größer.
Die Größe der Methylgruppen behindert die Rotation um die
C2-C3-Bindung. Das bezeichnet man allgemein als
Rotationsbarriere.
Die Höhe dieser Barriere ist ein Energiemaß und wird in kJ/mol angegeben. |