| Zeitbedarf: |
 | Vorbereitung: 10min |
 | Durchführung: 10min |
|
| Ziel/Effekt: |
Erzeugen einer Farbänderung bei
roten Rosen durch Säure/Base |
| Material: |
 | 2 Erlenmeyerkolben (250ml) |
 | feuerfeste Unterlage |
 | Gasmessglocke (5l) mit Stopfen |
 | Gasmessglocke (5l) mit Verbrennungslöffel |
 | Petrischale (d = 6cm) |
 | 2 Bechergläser (250ml) |
|
 | 2 rote Rosen ca. 20cm lang |
 | Schutzbrille |
 | Schutzhandschuhe |
 | Dewar-Gefäß 1l |
 | Brenner |
 | Feuerzeug |
 | Zellstofftuch |
|
| Chemikalien: |
 | Schwefel S
R11-36/37/38
S16-23-26-37/39 |
|
  |
 | Salzsäure (konz.) HCl
R34-37 S 26-45 |
|
 |
 | Diethylether (C2H5)2O
R12-19-22-66-67
S(2)-9-16-29-33 |
|
  |
 | Ammoniumhydroxid-Lösung (25%) NH3*aq
R34-50 S26-36/37/39-45-61 |
|
  |
 | 0,5l flüssiger Stickstoff N2
S9 |
|
|
| Vorbereitung:
A! |
Zur Entfernung
der natürlichen Wachsschicht der Rosen und eventuell vorhandener Konservierungsrückstände taucht man die Rosen mit der Blüte
für 5s in das mit Diethylether
gefüllte Becherglas. Die Rosen werden anschließend auf dem Zellstofftuch
abgelegt und getrocknet.
ACHTUNG: Der Ether muß vollständig und im
Abzug abgedampft sein, sonst kann es zu Verpuffungen kommen! |
Durchführung1:
A! |
Die erste Rose
wird in den Erlenmeyerkolben gestellt, welcher auf der
feuerfesten Unterlage steht. Nun wird die Gasmessglocke über den
Erlenmeyerkolben gestülpt. Der Verbrennungslöffel wird entnommen und
vollständig mit Schwefel gefüllt. Anschließend wird der Schwefel solange
in der Brennerflamme erhitzt, bis er flüssig ist und sich entzündet.
Nachdem man die Flamme vorsichtig ausgeblasen hat, wird der rauchende
Verbrennungslöffel in die Gasmessglocke gehängt. |
| Beobachtung1: |
Nach ca. 2-3 Min.
ist die rote Rose stark aufgehellt bis entfärbt. |
Durchführung2:
A! |
Die zweite Rose
wird in den anderen Erlenmeyerkolben gestellt. Die Petrischale wird mit
Ammoniumhydroxid-Lösung halbvoll gefüllt und 2cm neben den
Erlenmeyerkolben gestellt. Anschließend stülpt man die zweite
Gasmessglocke über den Erlenmeyerkolben und die Petrischale und
verschließt die Glocke mit dem Stopfen. |
|
Beobachtung2: |
Nach ca. 2-3 Min.
ist die rote Rose nachgedunkelt bis blau verfärbt. |
Durchführung3:
A! |
Die - wie oben
beschrieben - behandelten Rosen werden in das halb mit Salzsäure
gefüllte
Becherglas getaucht. |
|
Beobachtung3: |
Nach
einigen Sekunden färben sich die weiße und die blaue Rose wieder nach rot um. |
|
Durchführung4: |
Die beiden Rosen werden
so lange in das mit flüssigem Stickstoff gefüllte Dewar-Gefäß eingetaucht, bis der Stickstoff
aufhört zu sieden. Danach werden die Rosen auf den Tisch
geschlagen. |
|
Beobachtung4: |
Die Rosen zerspringen. |
| Entsorgung: |
Die Rosen können
nach gründlichem Waschen mit Wasser zum Hausmüll gegeben werden. Überschüssige Ammoniumhydroxid-Lösung wird vorsichtig in Wasser verdünnt,
neutralisiert und dann in den Abguss gegeben.
Der Diethylether wird in die organischen Lösungsmittelabfälle gegeben und
mögliche Schwefelrückstände werden im Abzug ausgebrannt. |
| Quellen: |
 | Wagner, G.: Chemie in faszinierenden Experimenten, 9. Aufl., Aulis-Verlag
Deubner, Köln,1997, S. 47 |
 | Kreissl, F. R., Krätz, O.: Feuer und Flamme, Schall und Rauch, 1.
Aufl., Wiley-VCH, Weinheim, New York, Chichester, Brisbane, Singapore,
Toronto, 1999, S. 220 |
 | Organische Chemie, Uni Würzburg |
|
|
Hintergrund: |
Der Mechanismus
basiert auf dem Einfluss von Säuren und Basen bzw. Nukleophilen auf die in
der Pflanzenwelt sehr verbreiteten blauen, violetten und roten
Blütenfarbstoffe, die Anthocyane. Der in den roten Rosen vorhandene
Farbstoff ist Cyanidin. Weiße Rose
Beim Verbrennen von Schwefel entsteht Schwefeldioxid, das mit Wasser
in einer Gleichgewichtsreaktion zu Hydrogensulfit und einem Proton
reagiert:
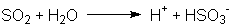
Durch nukleophile Addition des Hydrogensulfits an das Cyanidin, entsteht ein
stabiles, farbloses Addukt. Die Rose erscheint somit weiß. Diese Reaktion
ist eine
Gleichgewichtsreaktion. Bei der Reaktion mit Salzsäure bildet sich der
rote Blütenfarbstoff Cyanidin wieder zurück.
Blaue Rose
Bei der Behandlung der Rosen mit aufsteigenden
Ammoniumhydroxid-dämpfen kommt es zur Deprotonierung der
phenolischen OH-Gruppe und damit zur Ausbildung einer blauen chinoiden
Base. Die Rose erscheint somit blau.
Es handelt sich ebenfalls um eine Gleichgewichtsreaktion. Bei der
Reaktion mit Salzsäure bildet sich der rote Blütenfarbstoff wieder
zurück.
Zerspringen der Rosen
Der flüssige Stickstoff lässt das Wasser in der Rose gefrieren,
wodurch die Rose hart und zerbrechlich wird. |
| Hinweise: |
Eine ähnliche Reaktion lässt sich mit Kornblumen durchführen. Stellt
man eine blaue Kornblume in mit Schwefelsäure angesäuertes Wasser, färbt
sie sich in eine rote Kornblume um. |
| Did. Hinweise: |
 | Eignet sich zum Aufzeigen des Farbenwechsels bei Naturfarbstoffen in
verschiedenen pH-Bereichen. |
 | Geeignet als Einführung in Naturindikatoren wie Rotkohlsaft oder in
das Färben mit Naturfarbstoffen. |
 | Geeignet zur Darstellung der Beziehung zwischen Struktur und Farbe. |
|
| WWW: |
|