| |
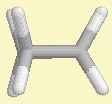
Cycloproapan |
Alle H-Atome stehen
ekliptisch zueinander. Was die Geometrie betrifft: 3 C-Atome bilden den Ring - ein gleichseitiges,
symmetrisches Dreieck.
Deshalb würde man einen C-C-C-Bindungswinkel von 60° erwarten, was man
durch Messung auch bestätigen kann. |
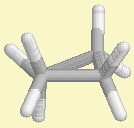
Cyclobutan |
Cyclobutan ist nicht quadratisch-planar,
sondern leicht gefaltet - so weichen die H-Atome in der Verbindung einer
all-ekliptischen
Konformation aus. Das vierte C-Atom erhebt sich über die Ebene der anderen
drei im Winkel von 25°. Wäre der Ring planar, würde
man 4 mal einen 90°-Winkel als C-C-C-Bindungswinkel erwarten.
In diesem Fall stünden alle H-Atome ekliptisch. Dies wäre energetisch
der ungünstigste Zustand. Ein wenig Stabilisierung erreicht das Molekül
durch die Faltung. |
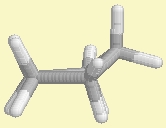
Cyclopentan |
Bei Cyclopentan stehen nur 2 der 5
Methylengruppen ekliptisch zueinander. Aufgrund der Faltung können die drei anderen
CH2-Gruppen einer ekliptischen Konformation ausweichen. Der Innenwinkel im
Fünfeck beträgt 108° und liegt
sehr nahe am idealen Tetraederwinkel von 109,5°. Wäre Cyclopentan
planar würden alle H-Atome in die ungünstige ekliptische Konformation
geraten. |
Wie könnte Ihrer Meinung nach ein ideal "entspanntes", ringförmiges Molekül
aussehen, in dem lauter gestaffelte Konformationen der H-Atome
vorhanden sind? |



 |