...zwischen zwei Ebenen (rot und blau), die man durch benachbarte Atome und
ihre Liganden legen kann:
|
 |
 |
|
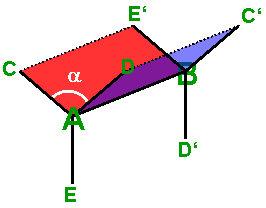
Zwischen den beiden Ebenen ABE'C und ABC'D liegt der Torsionswinkel
alpha. Er beschreibt die Torsion ("Verdrehung") von C' gegenüber C. |
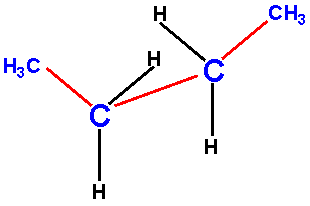
Der Torsionswinkel
beschreibt in Butan die Verdrehung zwischen den beiden Methylgruppen;
sie beträgt hier ca. 60°. |
Am Beispiel Butan würde ein Torsionswinkel 0° bedeuten, dass die beiden
Methylgruppen genau hintereinander zu liegen kommen.
Der Energieunterschied zwischen zwei Torsionspositionen wird
als Torsionsenergie (Torsion = Verdrehung) bezeichnet. Sinnvoll sind
die Positionen alle 60°.
Beispiel:
Die Torsionsenergie des Butanmoleküls beträgt etwa 19 kJ/mol. D.h. dreht man die Liganden eines C-Atoms um die
mittlere C-C-Bindung, so besteht zwischen der günstigsten und der ungünstigsten
Position eine Energiedifferenz von 19 kJ/mol.
Zum Vergleich: um die Wasserstoffbrückenbindung bei Wasser zu lösen, sind 20 kJ/mol
erforderlich; um eine C-C-Bindung zu spalten, benötigt man ca. 350 kJ/mol.
Somit liegt die abstoßende Wirkung der beiden Methylgruppen im Butan in etwa in dem Bereich von
Wasserstoffbrückenbindungen.
Der Übergang zwischen zwei benachbarten gestaffelten
Konformeren dauert durchschnittlich nur 10−11 Sekunden,
was einer Rotationsfrequenz von ca. 33 GHz entspricht. |