| Verbindung |
Vorschau |
Beschreibung |
| 1-Hexanol |
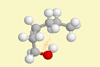 |
Lehrziel: 3D-Modell zur
Veranschaulichung des realistischen Verhaltens von Molekülen.
Ergebnis: Moleküle verhalten sich nicht starr, sondern es
herrscht freie Drehbarkeit um Einfachbindungsachsen. Wenn sich
die H-Atome zu nahe kommen, stoßen sie sich gegenseitig ab.
|
|
Ethan |
 |
Lehrziel:
Veranschaulichung der
Drehbarkeit um Einfachbindungsachsen bei Ethan mit einem
Kalottenmodell.
Ergebnis: Es herrscht freie Drehbarkeit um die
Einfachbindung. Ethan besitzt verschiedene Konformationen.
|
|
Ethan
|
 |
Lehrziel: Demonstration der Konformere von Ethan und
Anzeige der jeweiligen Energiewerte (Abstoßung der Atome).
Ergebnis: H-Atome auf Deckung (ekliptisch) sind
energetisch am ungünstigsten, H-Atome auf Lücke (gestaffelt)
sind energetisch günstig.
|
|
Butan |
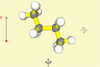 |
Lehrziel: Demonstration der Konformere von
Butan und Anzeige der jeweiligen zugehörigen Energiewerte
(Abstoßung der Atomgruppen), Erklärung der Rotationsbarriere.
Ergebnis: Die Größe der Reste der an
der Rotation um die
C-C-Bindung beteiligten C-Atome ist ausschlaggebend für die
Abstoßungskräfte. Die Größe der Methylgruppen behindert die
Rotation um die C2-C3-Bindung. Das bezeichnet man allgemein als
Rotationsbarriere.
|
|
Cyclopropan |
 |
Lehrziel:
Veranschaulichung der ekliptischen Stellung der H-Atome
zueinander.
Ergebnis: Es handelt sich um ein starres Molekül mit nur
einer Konformation (gleichseitiges, symmetrisches Dreieck mit
einem C-C-C-Bindungswinkel von 60°).
|
|
Cyclobutan |
 |
Lehrziel: Veranschaulichung
der leichten Faltung des Moleküls. Das vierte
C-Atom erhebt sich über die Ebene der anderen drei im Winkel von
25°.
Ergebnis: Alle H-Atome weichen der all-ekliptischen
Konformation aus, dadurch ergibt sich ein energetisch
günstigerer Zustand.
|
|
Cyclopentan |
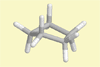 |
Lehrziel: Veranschaulichung
des Baus des gefalteten Moleküls.
Ergebnis: Nur zwei der fünf
Methylengruppen stehen ekliptisch zueinander und der Innenwinkel
beträgt 108°. Wäre Cyclopentan planar würden
alle H-Atome in die ungünstige ekliptische Konformation geraten.
|
|
Cyclohexan
Sesselform |
 |
Lehrziel:
Demonstration der Sesselform von Cyclohexan (Sessel- und
Twistform sind Konformere).
Ergebnis: Alle H-Atome stehen
gestaffelt. Deshalb ist sie die energetisch günstigste
Konformation.
|
|
Cyclohexan
Twistform 1 |
 |
Lehrziel:
Demonstration der Twistform 1 von Cyclohexan.
Ergebnis: H-Atome benachbarter C-Atome
sind nicht exakt, aber nahezu gestaffelt; es gibt keine
ekliptischen H-Atome.
|
|
Cyclohexan
Twistform 2 |
 |
Lehrziel:
Demonstration der Twistform 2 von Cyclohexan.
Ergebnis: Diese Konformation von Cyclohexan ist
energetisch identisch mit Twistform 1.
|
|
Cyclohexan
Wannenform |
 |
Lehrziel:
Demonstration der Wannenform als Skelettformel.
Ergebnis: Diese Konformation ist
energetisch ungünstiger als die Sessel- oder die Twistform.
|
|
Cyclohexan
Sesselform |
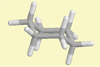 |
Lehrziel:
Veranschaulichung der energetisch günstigsten Konformation als
Stäbchenmodell.
Ergebnis: Alle H-Atome stehen
gestaffelt zueinander. Das Molekül ist nicht planar, sondern
mehrfach gewinkelt gebaut.
|
|
Cyclohexan
Sesselform |
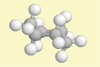 |
Lehrziel: Demonstration der energetisch günstigsten
Konformation als Kugel-Stäbchen-Modell.
Ergebnis: Alle H-Atome stehen gestaffelt
zueinander. Das Molekül ist nicht planar, sondern mehrfach
gewinkelt gebaut.
|
|
Cyclohexan
Twistform 1 |
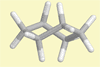 |
Lehrziel:
Veranschaulichung des Molekülbaus der Twistform 1.
Ergebnis: H-Atome benachbarter
C-Atome stehen nicht exakt, aber nahezu gestaffelt
und es gibt keine ekliptischen H-Atome.
|
|
Cyclohexan
Wannenform |
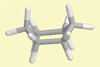 |
Lehrziel:
Veranschaulichung des energetisch ungünstigen Konformers.
Ergebnis: An den 6 C-C-Bindungen stehen zwei mal die
H-Atome ekliptisch und vier mal gestaffelt zueinander.
|
|
Cycloheptan |
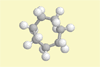 |
Lehrziel:
Demonstration des Vorhandenseins von Konformeren bei höheren
Homologen der Cycloalkane.
Ergebnis: Durch Vergrößerung der Anzahl der Ringatome ist
das Molekül nicht mehr starr. Durch den
Ringschluss kann aber um keine der C-C-Bindungen mehr ganz
herumgedreht werden.
|
| Cyclohexan
Video (mpg) |
 |
Lehrziel: Veranschaulichung
der Übergänge zwischen den einzelnen Konformationen.
Ergebnis: Energetisch am höchsten
liegt der Halbsessel. Dieser wird beim "Umklappen" der Wanne in
die energetisch niedrigste Konformation, den Sessel,
durchlaufen. Während die Wannen-, Twist- und Sessel-Konformation
über längere Zeit erhalten bleiben, handelt es sich beim
Halbsessel nur um einen Übergangszustand und nicht um eine
Konformation. Die Twist-Konformation wird beim Umklappen in die
Sesselform sichtbar.
|

