|
NuT
C12 |
Experimente für den
Chemieunterricht
Luft im Wasser? (1)
|
L |
| Zeitbedarf: |
(1) 10 Minuten + (2) ggf. 30
Minuten Abkühlzeit + (3) 5 Minuten |
| Ziel: |
Im Wasser sind Gase gelöst, die
aus der Luft stammen. |
| Material: |
 | Becherglas 600ml hohe Form |
 | Trichter aus Glas d=10cm (muss ganz in das Becherglas passen!) |
 | Thermometer T<100°C |
|
 | Reagenzglas d=13-16mm |
 | Heizplatte |
 | Stativ, Muffe, Klammer |
 | Filzstift, wasserfest |
|
| Chemikalien: |
 | frisches Trinkwasser |
|
|
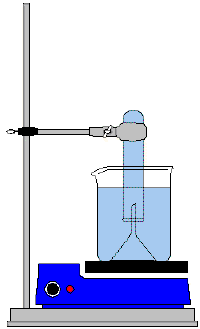
Durchführung1:
(qualitativ) |
1. Stelle den Trichter nach Skizze in das Becherglas und fülle es bis
ca. 3cm über das Trichterende mit frischem Leitungswasser.
2. Befestige ein Reagenzglas, das vollständig mit frischem Wasser
gefüllt wurde, oberhalb des Trichters. Die Reagenzglasöffnung muss dabei
in das Wasser eintauchen.
3. Erhitze das Wasser bis etwa 70-80°C. Wichtig: es darf nicht sieden!
|
 |
| Beobachtung: |
In dem Reagenzglas steigen bei
Erwärmung Bläschen nach oben. |
| Deutung: |
Erste Annäherung: In den
Gasbläschen ist Luft. Diese
Luft muss vorher im Wasser gelöst gewesen sein.
Zweite Annäherung: In den Gasbläschen ist ein luftähnliches
Gemisch. Die Zusammensetzung des Gemisches unterscheidet sich deshalb von
Luft, weil die Löslichkeit der
Luftgase in Wasser sehr unterschiedlich ist.
Siehe Experimente Löslichkeit von
Kohlenstoffdioxid in Wasser
und
Löslichkeit von Sauerstoff in
Wasser. |
Durchführung2:
(dynamisch) |
1. Markiere nach Erreichen von
70-80°C den Gasstand mit dem Filzstift.
2. Lasse 30 Min. abkühlen und markiere wieder.
Suche eine Erklärung für das Ergebnis:
- dass 1. überhaupt Gas entweicht (jüngere Schüler) und
- dass 2. die Gasmenge nach 30 Minuten geringer zu sein scheint (ältere
Schüler)! |
Durchführung3:
(quantitativ) |
Man kann die Menge des Gases
bestimmen, indem man abkühlen lässt, den Gasstand markiert, das Wasser
ausgießt und bis zur Marke wieder Wasser mit einer Messpipette
hineinfüllt.
Vergleiche mit den Werten unten. Passen die Zahlen zusammen? |
| Entsorgung: |
- |
| Quelle: |
Nach
http://www.espere.net/Germany/water/dewatexpsolde.html,
24.5.04 |
| Hintergrund: |
Unter dem Trichter befinden sich
ca. 220ml Wasser. Aus diesem Wasservolumen stammt das ausgesonderte Gas.
Löslichkeiten der Luftgase in je 100ml Wasser:
| T [°C] |
V(Sauerstoff) |
V(Stickstoff) |
V(Kohlenstoffdioxid) |
| 0° |
4.9 ml |
23,2 ml |
171 ml |
| 20° |
3.1 ml |
12,7 ml |
88 ml |
| 100° |
1.7 ml |
? |
? |
Lit.: Römpp, Chemielexikon, 9. Aufl., Thieme, Stuttgart 1994. |
| Did. Hinweise: |
1. Der Versuch kann auf zwei Ebenen
ausgewertet werden:
 | für jüngere Schüler (Jgst. 5-7) auf der qualitativen Ebene:
erklären, welcher Art das entweichende Gas ist; |
 | für ältere Schüler (ab Jgst. 8) auf der quantitativen Ebene über
Plausibilität gegenüber den Löslichkeiten und zusätzlich ggf. die
Temperaturabhängigkeit des festgestellten Volumens (Gasgesetze). |
2. Diskutieren Sie mit den Schülern
die Fragen, sofern sie die Grundlagen kennen, um sie auch beantworten zu
können:
 | Was spricht dafür, dass in den Bläschen
nicht Luft / Sauerstoff ist? |
 | Warum darf das Wasser nicht sieden? |
 | Warum misst man bei D2 unterschiedliche Gasmengen bei den beiden Temperaturen? |
 | Warum sind die gemessenen Gasmengen von D3 geringer, als man aus den
Literaturwerten errechnen kann? |
3. D3 kann man auch von den Schülern erarbeiten lassen.
Aufgabenstellung: "Überlege dir eine Methode, wie man die Gasmenge im RG
messen könnte!" |
Download als *.doc, 56k
Download als *.pdf, 248k
© Walter.Wagner
ät uni-bayreuth.de,
Stand:
08.03.11
|