
Bild 13: Wassertropfen auf einer Silikonplatte 1

Bild 23: Wassertropfen auf einer Silikonplatte 2

Bild 31: Wassertropfen auf einer Silikonplatte 3
Hintergrund:
Wasser ist eine chemische Verbindung aus Sauerstoff und
Wasserstoff. Die Bezeichnung "Wasser" wird besonders für den flüssigen
Aggregatzustand verwendet, im festen - also gefrorenen Zustand - wird es "Eis"
genannt, im gasförmigen Zustand "Wasserdampf" oder einfach nur "Dampf".
Aufbau des Wassermoleküls
Das Wassermolekül besteht aus zwei Wasserstoffatomen und einem
Sauerstoffatom. Geometrisch ist das Wassermolekül gewinkelt und entspricht in
der VSEPR-Theorie dem AB2E2-Typ.
Die zwei Wasserstoffatome und die zwei Elektronenpaare sind folglich in die
Ecken eines gedachten Tetraeders gerichtet.
Der Winkel, den die beiden OH-Bindungen einschließen, beträgt
104,45° (aufgerundet: 105°). Er weicht aufgrund des erhöhten Platzbedarfs der freien Elektronenpaare
vom idealen Tetraederwinkel (~109,47°) ab.
Die Bindungslänge der O-H-Bindungen beträgt jeweils 0,096nm, der Abstand der
beiden Wasserstoffatome zueinander 0,152nm (siehe Abb.1). [1]
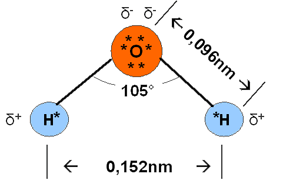
Abb. 1: Wassermolekül [2]
Dipolmoment
Sauerstoff hat eine höhere Elektronegativität als
Wasserstoff. Durch die dreieckige Geometrie des Wassermoleküls und die
unterschiedlichen Partialladungen der Atome hat das Wassermolekül auf der Seite des Sauerstoffs
eine negative und auf der Seite der beiden Wasserstoffatome insgesamt zwei positive Partialladungen. Diese
Ladungsunterschiede bewirken das Dipolmoment. Entsprechend der VSEPR-Theorie,
sind die beiden Elektronenpaare auf dem Sauerstoffatom für die winklige Anordnung der beiden
Wasserstoffmoleküle verantwortlich. Aufgrund dieser winkligen Anordnung kommt es
zur Dipolbildung und damit zu den besonderen Eigenschaften des Wassers.
Durch die unterschiedlichen Partialladungen kann das Molekül von bestimmten
elektromagnetischen Wellen, den Mikrowellen, in Schwingungen versetzt werden,
was zur Erwärmung des Wassers führt.
Wasserstoffbrückenbindungen
Aufgrund des polaren Charakters der Wassermoleküle kommt es
zur Ausbildung von Wasserstoffbrückenbindungen zwischen den einzelnen
Wassermolekülen, wodurch ausgeprägte zwischenmolekulare Anziehungskräfte
entstehen. Es handelt sich bei Wasserstoffbrückenbindungen jedoch um keine
beständige, feste Verkettung. Der Verbund der über Wasserstoffbrückenbindungen
unbeständig verketteten Wassermoleküle besteht nur Bruchteile von Sekunden,
wonach sich die einzelnen Wassermoleküle wieder aus dem Verbund lösen und sich
in einem ebenso kurzen Zeitraum erneut mit einem anderen Wassermolekül
verketten. Dieser Vorgang wiederholt sich ständig.
Für die Ausbildung der Wasserstoffbrückenbindungen ist unter
anderem der kleine Durchmesser des Wasserstoffatoms von Bedeutung, da sich
das Wasserstoffatom nur so in ausreichendem Maße dem Sauerstoffatom nähern kann. Die höheren
Homologen des Wassers, zum Beispiel Schwefelwasserstoff H2S, bilden
derartige Bindungen aufgrund der geringeren Elektronegativitätsdifferenz
zwischen den Bindungspartnern nicht aus.
Die Verkettung der Wassermoleküle durch
Wasserstoffbrückenbindungen ist die Ursache für viele besondere Eigenschaften
des Wassers. Beispielsweise ist Wasser trotz der geringen molaren Masse von rund 18g/mol unter Standardbedingungen flüssig. H2S liegt im Gegensatz
dazu gasförmig vor. Auch dass Wasser seine größte Dichte bei rund vier Grad
Celsius hat (Dichteanomalie) und somit Eis auf flüssigem Wasser schwimmen kann,
ist auf die Wasserstoffbrückenbindungen zurückzuführen. [1]
Bildinformation:
Die Bilder zeigen einzelne Wassertropfen auf einer
Silikonplatte. Die Tropfen wurden mit einer Kaltlichtquelle belichtet und mit
Vergrößerungsfaktor 5 photographiert.
Verwendung:
Die vorliegenden Bilder können für private und nichtkommerzielle Lehrzwecke
benutzt werden. Als minimaler Bildnachweis müssen das Copyright und der Urheber
in folgender Form vermerkt werden: © Kathrin Götz
Für Bildbestellungen in höherer Auflösung bitte E-Mail an folgende Adresse:
seminar-goetz ät gmx.de
Quellen:
-
www.biologie.de/biowiki/Wasser, Stand 13.12.05
-
Falbe, J., Regitz, M.: Römpp Chemie Lexikon, 9. Aufl., Georg
Thieme Verlag, Stuttgart, New York, 1992, S. 4994
© Walter.Wagner ät uni-bayreuth.de,
Stand:
03.07.12