Hintergrund zu:
Weinprobe
Phenolphthalein
Phenolphthalein
(3,3-Bis(4-hydroxyphenyl)-phthalid) ist ein weißes, kristallines
Pulver, unlöslich in Wasser, leicht löslich in Alkohol oder
Alkalien.
Im alkalischen Bereich (pH 8.4-10.0) überwiegt die chinoide
Struktur (siehe Abb.1). Diese deprotonierte Form des Indikators verfügt über ein delokalisiertes
pi-Elektronensystem,
wodurch
die Phenolphthalein-Lösung pink erscheint.
Im sauren bis neutralen pH-Bereich liegt Phenolphthalein
überwiegend in der Phthalid-Form vor. Eine Delokalisierung der
pi-Elektronen über die drei Benzolringe ist hier jedoch nicht mehr
möglich. Dieses System ist nun zu klein, um über eine Anregung der
Elektronen eine Farberscheinung aufzuzeigen. Der Farbumschlag des Indikators von farblos nach pink kann durch Säurezugabe rückgängig gemacht werden.
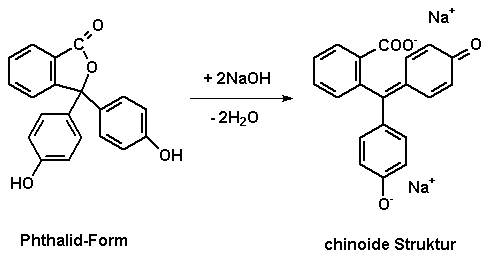
Abb.1: Phenolphthalein [2]
Phenolphthalein ist ein oft genutzter Säure-Base-Indikator bei
der Titration starker Basen. Die Rotfärbung ist noch in einer
Verdünnung von 1:1000000 erkennbar. [1]
Eisenthiocyanat
Durch das Versetzen einer Ammoniumthiocyanat-Lösung mit einer Eisen(III)chlorid-Lösung kommt
es zur Bildung eines blutrot gefärbten Eisenthiocyanat-Komplexes:
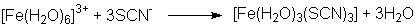
Berliner Blau
Unter den Komplexverbindungen des Eisens
gehören die Cyanokomplexe ("Hexacyanoferrate") zu den beständigsten. Die
Kaliumsalze sind als "Gelbes Blutlaugensalz" K4[Fe(CN)6]
oder "Rotes Blutlaugensalz" K3[Fe(CN)6] bekannt. Der
Eisen(II)-Komplex ([Fe(CN)6]4-) ist thermodynamisch
und kinetisch stabiler als der Eisen(III)-Komplex ([Fe(CN)6]3-).
Der Eisen(III)-Komplex kann eher als Oxidationsmittel fungieren:
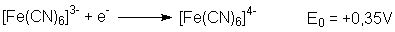
Versetzt man eine Lösung des gelben Blutlaugensalzes mit
Eisen(III)-chlorid oder eine Lösung des roten Blutlaugensalzes mit
Eisen(II)-chlorid, so entsteht in beiden Fällen bei einem Molverhältnis von
1:1 das gleiche, kolloid gelöste "lösliche Berliner Blau":
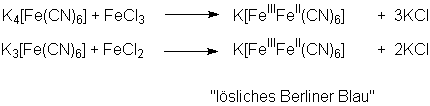
Bei Zugabe überschüssiger Eisen(III)- bzw. Eisen(II)ionen zu [Fe(CN)6]4-
bzw. [Fe(CN)6]3- entstehen blaue Niederschläge, die
als "unlösliches Berliner Blau" bzw. "unlösliches Turnbulls-Blau"
unterschieden werden. Sie sind jedoch chemisch identisch:
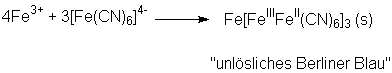
Bei der Umsetzung von Eisen(III)-chlorid mit rotem Blutlaugensalz oder
Eisen(II)-chlorid mit gelbem Blutlaugensalz entstehen hingegen farblose
oder nur schwach gefärbte Lösungen:
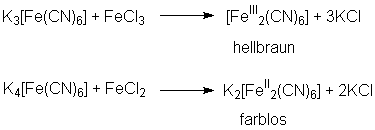 . [3]
. [3]
Heptan
Heptan ist ein kettenförmiger Kohlenwasserstoff aus
der Stoffgruppe der Alkane mit der Summenformel C7H16.
Unter Heptan versteht man gewöhnlich das unverzweigte
n-Heptan, welches neun Isomere besitzt. N-Heptan ist in Wasser unlöslich
und leicht entzündlich - sein Flammpunkt liegt bei -4°C, die
Zündtemperatur bei 285°C. Zwischen einem Luftvolumenanteil
von 1,1 bis 6,7 Prozent bildet es explosive Gemische. In einer
Lösung mit Wasser steigt Heptan aufgrund seiner geringeren Dichte im
Vergleich zu Wasser nach oben (Dichte von Wasser: 0,997 g/cm3
bei 25°C; Dichte von Heptan: 0,681 g/cm3). [4]
Natriumhydrogencarbonat
Natriumhydrogencarbonat
wird auch mit den Trivialnamen Natriumbicarbonat, Doppeltkohlensaures
Natrium oder kurz Natron bezeichnet. NaHCO3 ist ein feines, weißes
Pulver und zerfällt oberhalb einer Temperatur von ca. 65°C
in Wasser, Kohlendioxid und Natriumcarbonat. Oberhalb 300°C ist
die Umwandlung vollständig. Säuren werden durch NaHCO3 unter
Kohlendioxid-Entwicklung neutralisiert:
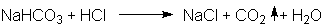
Im Versuch reagieren Natriumhydrogencarbonat
und Citronensäure
erst in Gegenwart von Wasser auf die eben beschriebene Weise
miteinander. [5]
Die Neutralisationsreaktion des Natrons in
Hinblick auf Säuren, hat Natriumhydrogencarbonat als ein Mittel gegen Sodbrennen gebräuchlich
gemacht.
Wegen der thermischen Zersetzung von Natriumhydrogencarbonat wird
es seit langer Zeit in der Lebensmitteltechnik als Backtriebmittel
- im Backpulver zusammen mit Natriumhydrogenphosphat - und als
Feuerlöschpulver genutzt. [6]
Literatur:
- Falbe, J., Regitz, M.: Römpp Chemie Lexikon, 9. Aufl., Georg Thieme
Verlag, Stuttgart, New York, 1991, S. 3354
-
http://www.vs-c.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_10/vlu/indikatoren
_darst.vlu/Page/vsc/de/ch/11/aac/praktikum/indikatoren/
phenolphthalein.vscml.html, Stand 17.02.06
-
www.cci.ethz.ch/experiments/berliner/de/vertiefung/1.html, Stand
14.02.06
-
http://de.wikipedia.org/wiki/Heptan, Stand 15.11.05
- Falbe, J., Regitz, M.: Römpp Chemie Lexikon, 9. Aufl., Georg Thieme
Verlag, Stuttgart, New York, 1991, S. 2928
-
http://natriumhydrogencarbonat.adlexikon.de/Natriumhydrogencarbonat.shtml,
Stand 14.02.06