Hintergrund zu:
Regenbogen im Tomatensaft
Die charakteristische rote Farbe der Tomaten beruht
hauptsächlich auf dem Gehalt an Lycopen, einem Carotinoid.
Reife Tomaten haben einen besonders hohen Lycopenanteil (ca. 3,9 - 5,6mg
Lycopen/100g reifer Tomaten). Dosentomaten enthalten prozentual mehr Lycopen,
da ihnen bei der Verarbeitung Wasser entzogen wird (ca. 10mg Lycopen/100g Doseninhalt). Konzentriertes Tomatenmark enthält
sogar ca. 62mg Lycopen/100g
Tomatenmark. Die
Verfügbarkeit von Lycopen aus erhitzten
Produkten (z.B. Tomatensaft) ist höher als aus rohen Produkten, da beim Erhitzen die pflanzlichen
Zellstrukturen aufgebrochen werden und das Lycopen gelöst wird.
[2] Durch besonders langes Kochen der Tomaten werden also mehr Lycopene freigesetzt als beim kurzen
Dünsten. [1][2]
Lycopene sind
langkettige, ungesättigte Kohlenwasserstoffe (Alkene)
mit 13 C-C-Doppelbindungen, wovon 11 konjugiert sind.
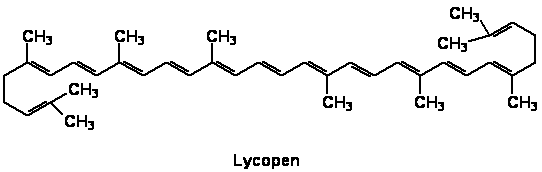
Die Länge des
konjugierten pi-Elektronensystems im Lycopen ist
für seine Absorption in der blau-grünen Region des sichtbaren Spektrums
verantwortlich und damit auch für seine rote Farbe. Bei einer
elektrophilen Addition an eine pi-Doppelbindung
verkürzt sich die Länge des konjugierten Doppelbindungsystems, was in
einer Verkürzung der absorbierten Wellenlänge resultiert. Die Absorption
verschiebt sich also in die Richtung des UV-Spektralbereiches und die
Verbindung erscheint nun farblos. Dies geschieht, wenn man eine Lösung von
Lycopen (in den meisten Solventien) mit Bromwasser versetzt. Wie entstehen
dann aber die zu beobachtenden blauen und grünen Farben? Einen Hinweis
gibt der Reaktionsmechanismus der Addition von Brom an eine Doppelbindung: [3]
Diese Addition läuft in
zwei Stufen ab. Im ersten Reaktionsschritt kommt es zu Wechselwirkungen
zwischen einem Bromatom des Brommoleküls und den pi-Elektronen
der Doppelbindung. Es bildet sich der so genannte pi-Komplex
(Charge-Transfer-Komplex) aus, in dem das Brommolekül polarisiert
vorliegt.
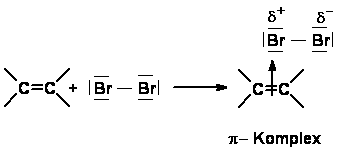
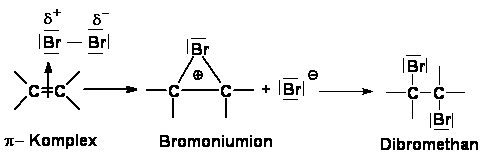
Im zweiten Reaktionsschritt wird das polarisierte Brommolekül
heterolytisch gespalten. Das positiv geladene Kation wird von den negativ
geladenen Elektronen der Doppelbindung angezogen und an das Ethen
gebunden (elektrophiler Angriff). Das Ethen liegt nun als positiv geladenes
Bromoniumion vor. Das
zweite Bromatom liegt als negativ geladenes Anion vor, da es beide
Bindungselektronen vom Brommolekül erhalten hat. Das Bromanion ist
nukleophil und es erfolgt, wegen des großen Raumbedarfs der Ionen, ein
"Angriff" von der Rückseite des Bromoniumions. Man spricht deshalb von
einem Rückseitenangriff. Durch diese nukleophile Addition kommt es zur
Bildung des Dibrommethans. Die ursprünglich vorhandene C-C-Doppelbindung
ist nun verschwunden. [4][5]
Absorbiert ein solcher pi-Komplex Licht, geht
er in einen angeregten Zustand über, wobei ein pi-Elektron
vom Donor (dem Alken) auf den Akzeptor (das Brom) übergeht. Das Erscheinen
einer neuen Absorptionsbande bei längerer Wellenlänge als der des Donors
ist charakteristisch für solche Absorptionen. Da diese Absorptionsbanden
im roten Spektralbereich liegen, weist der pi-Komplex eine
blau-grüne Farbe auf. Da die Lycopenmoleküle in den Lipidaggregaten der
Zellmembran der Tomaten immobilisiert sind und nahe zusammengehalten
werden, ist die Zersetzungsrate für die gebildeten
Komplexe stark reduziert. Das bedeutet, dass der pi-Komplex
eine ungewöhnlich lange Lebensdauer aufweist. Dies wiederum führt - was
den Effektversuch angeht - zum Vorherrschen der Absorptionsbanden des
pi-Komplexes.
Das Auftreten der Regenbogenfarben bei der Bromierung von Tomatensaft
wird dadurch erklärt, dass in der blauen Farbschicht die
π-Komplexe vorherrschen. Dort, wo die grüne
Farbe auftritt, ist die Konzentration des gelbbraunen Bromwassers so hoch,
dass es sich mit der blauen Farbe zu einem dunklen Grün vermischt. Wird
die Konzentration des Bromwassers noch höher, tritt eine gelbe Färbung und
schließlich eine orange Färbung auf. Die rote Farbe beruht auf
Tomatensaft, der noch nicht mit Bromwasser reagiert hat. Daher bleibt die
rote Farbe des Lycopens sowohl an der Oberfläche der Flüssigkeitssäule
(das schwere Bromwasser diffundiert schnell in den Tomatensaft ein, daher
keine Reaktion an der Oberfläche) als auch am Boden (das Bromwasser ist
durch Reaktion mit dem Lycopen weitgehend aufgebraucht) erhalten. [3]
Literatur:
-
http://de.wikipedia.org/wiki/Lycopen, Stand 17.11.05
-
http://www.bleibjung.de/018f1091f809ea629/018f1091f90bc744d
/018f1092120d10b0b.html, Stand 17.11.05
-
http://www-organik.chemie.uni-wuerzburg.de/studinfo/erlebnis/
regenbogen_tomatensaft.pdf, Stand 17.11.05
-
http://www.chempage.de/theorie/elektrophadd.htm, Stand 21.02.06
-
http://www.calsky.com/lexikon/de/txt/e/el/elektrophile_addition.php,
Stand 21.02.06