Hintergrund zu:
Bunte Standfeuer
Erklärung der Flammenfärbung
Alle Elemente senden bei hohen Temperaturen Licht aus, doch für
Elemente, die eine Flammenfärbung aufweisen, geschieht dies schon bei den
Temperaturen, die in einer Flamme herrschen. Die verschiedenen Flammenfärbungen kann man in der Analytik zur
Analyse von chemischen Elementen oder deren Ionen benutzen. Die
Flammenfärbung beruht darauf, dass die Elemente oder Ionen in einer
farblosen Flamme Licht spezifischer Wellenlängen abgeben, das für jedes
Element charakteristisch ist. Die Flammenfärbung entsteht durch
Energieumwandlung von Wärmeenergie zu Strahlungsenergie. Stoffe mit
Flammenfärbung sind oft in der Pyrotechnik eingesetzt.
Die äußersten Elektronen (Valenzelektronen) werden durch Zufuhr von
Energie (die in diesem Fall durch eine Verbrennung entsteht) angeregt und auf ein
höheres
Energieniveau gehoben. Diese Elektronen
besitzen nun eine höhere "potentielle" Energie. Die negativ geladenen
Elektronen fallen aber meist in Sekundenbruchteilen wieder auf ein
energieärmeres Energieniveau zurück, da der angeregte Zustand sehr
instabil ist. Die beim Zurückfallen frei werdende
Energie wird als Photon (Lichtteilchen) abgegeben. Man spricht von einem
"Quant". Es ist durch eine genau definierte Energie und somit auch mit
einer einzigen Wellenlänge gekennzeichnet.
Das Zurückfallen der Elektronen auf energieärmere Energieniveaus kann
auch stufenweise erfolgen. Bei jedem Zurückfallen dieses Elektrons auf ein
energieärmeres Energieniveau gibt es nun Licht einer ganz bestimmten Farbe
ab. Die freigegebene Lichtenergie hängt von der Differenz der
Energieniveaus (ΔE) ab. Diese Differenz ist für jedes Element
unterschiedlich. Die Energie der Photonen bestimmt ihre Wellenlänge (λ)
und damit Farbe, so ergibt sich die spezifische Flammenfärbung:
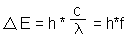
c = Lichtgeschwindigkeit
h = Plancksches Wirkungsquantum
f = Frequenz
Weist ein Element eine spezifische Flammenfärbung auf, dann weisen auch
viele seiner Ionen in Verbindungen diese Flammenfärbung auf (Beispiel:
Bariumsulfat weist eine grünliche Flammenfärbung auf, Bariumphosphat
nicht). Sehr viele Elemente senden bei hohen Temperaturen sichtbare
Spektrallinien aus. Einige Elemente wurden sogar nach der Farbe ihrer bei
der Flammenfärbung beobachteten Spektrallinien benannt: Caesium
(lateinisch: himmelblau) , Rubidium (lateinisch: dunkelrot) und Indium
(nicht nach Indien, sondern nach einer indigoblauen Spektrallinie). Die
Verbindung Kupferchlorid weist eine besonders schöne, azurblaue
Flammenfärbung auf. Die Tabelle zeigt die Flammenfärbung einiger Elemente:
|
Element |
Flammenfärbung |
| Antimon |
fahlblau |
| Arsen |
fahlblau |
| Barium |
fahlgrün |
| Blei |
fahlblau |
| Borat (Bor) |
kräftig grün |
| Cadmium |
rot |
| Calcium |
ziegelrot |
| Caesium |
blau |
| Kalium |
violett |
| Kupfer |
grün |
| Lithium |
kaminrot |
| Natrium |
gelb |
| Rubidium |
tiefrot |
| Strontium |
rot |
| Yttrium |
rot |
Literatur:
-
http://chemie.naturtoday.de/Flammenf%C3%A4rbung, Stand 18.10.05