| Zeitbedarf: |
 | Vorbereitung: 2min |
 | Durchführung: 3min |
|
| Ziel/Effekt: |
Demonstration einer
stark exothermen Reaktion;
Aluminiumkügelchen "tanzen" unter Feuererscheinungen auf Brom. |
| Material: |
 | Reagenzglas (d = 3cm) |
 | Becherglas (500ml) |
 | Pinzette |
 | Schutzbrille |
 | Schutzhandschuhe |
|
 | Fortuna-Pipette (2ml) |
 | Spatel (Breite 5mm) |
 | Stativ, Muffe, Klammer |
 | Abzug |
|
| Chemikalien: |
 | Aluminiumpulver Al
R10-15 S(2)-7/8-43 |
|
 |
 | Brom Br2
R26-35-50
S(1/2)-7/9-26-45-61 |
|
   |
 | Natriumthiosulfat Na2S2O3
S22-24/25 |
 | Aluminiumfolie |
 | Sand |
 | dest. Wasser |
|
|
| Vorbereitung: |
Im Abzug wird das
Reagenzglas senkrecht in das Stativ eingespannt. Unter das Reagenzglas
stellt man das halb mit Sand befüllte Becherglas. Aus der Aluminiumfolie
werden etwa 7 erbsengroße Kügelchen gedreht. |
| Durchführung: |
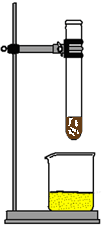 |
Mit der Pipette werden vorsichtig ca. 2ml Brom
in das Reagenzglas eingefüllt. Anschließend gibt man eine Spatelspitze Aluminiumgranulat
und unter Zuhilfenahme der Pinzette 3 Aluminiumkügelchen in das
Reagenzglas.
Danach Abzug sofort schließen!!! |
| Beobachtung: |
Nach 5s beginnt eine heftige Reaktion. Unter Feuererscheinungen und
Rauchentwicklung verbrennen die Aluminiumkügelchen, während sie auf der
Bromoberfläche hin und her tanzen. |
| Entsorgung: |
Der Überschuss an
Brom wird mit Natriumthiosulfat-Lösung umgesetzt und mit den
halogenhaltigen Chemieabfällen entsorgt. |
| Quelle: |
|
| Hintergrund: |
Aufgrund der unterschiedlichen
Redoxpotentiale der beiden Edukte Brom und Aluminium läuft eine
Redoxreaktion nach folgendem Schema ab:
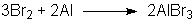
Brom wird dabei zu Br - reduziert und Aluminium zu Al3+
oxidiert. |
| Hinweise: |
 | Der Versuch kann solange wiederholt werden, bis das
Brom im Reagenzglas aufgebraucht ist. |
 | Vorsicht: Es kann vorkommen, dass die Reaktion so heftig ist,
dass ein Teil des Broms oder des Aluminiums mit dem entstehenden Rauch
hinausgeschleudert wird! Daher keine brennbaren Materialien in der Nähe
aufbewahren! Da das Reagenzglas durch die exotherme Reaktion sehr heiß
wird, sollte man es nach dem Versuch erst abkühlen lassen. |
 | Brom ist wassergefährdend (WGK 2). Wegen der starken Ätzwirkung
verbietet sich auch die Entsorgung von Kleinstmengen im Ausguss von
selbst. Wegen des hohen Preises sollte Brom niemals als Abfall entsorgt,
sondern aufgebraucht werden. Eine Aufreinigung wird wohl kaum jemals
notwendig sein. Falls doch, lässt es sich unter Verwendung eines
wirksamen Kühlers leicht destillieren. Enthaltenes Wasser kann man durch
ausgiebiges Verrühren mit konzentrierter Schwefelsäure entfernen. Nicht
lohnende Kleinmengen können mit einem Reduktionsmittel zum Halogenid
reduziert und danach ins Abwasser gegeben werden. (Bromide sind, sofern
das Kation nicht toxisch ist, schwach wassergefährdend (WGK 1).) Das als
Reduktionsmittel oft empfohlene Thiosulfat gibt bei der Reaktion häufig
unlösliche Niederschläge. Mit Sulfit-Lösungen entstehen dagegen nach der Desaktivierung klare Lösungen. Da in diesem Fall die bei der
Reaktion entstehende Bromwasserstoffsäure zu einer unerwünschten
Entwicklung von Schwefeldioxidgasen führen kann, gibt man bei größeren
Mengen zweckmäßig noch Natronlauge hinzu. |
|
| Did. Hinweise: |
 | Beispiel einer exothermen Reaktion bzw. einer Redoxreaktion. |
 | Beispiel einer Synthese aus Elementen. |
|
| WWW: |
|