|
NuT
C11 |
Experimente für
Natur und Technik
Kohlenstoffdioxid und Wasser
|
L |
| Zeitbedarf: |
15 Minuten. |
| Ziel: |
Löslichkeit von Gasen in Wasser,
hier Kohlenstoffdioxid. |
| Material: |
 | Messzylinder aus Kunststoff, 500ml, möglichst breite Form |
 | Parafilm o.ä zum Abdecken |
|
 | Stativ, Muffe, Klammer |
 | Kunststoffschüssel (ca. 3-5 Liter) mit Wasser |
|
| Chemikalien: |
 | 2-3 Brausetabletten aus dem Lebensmittelhandel (Größe ca. 4g) |
|
Vorbereitung:
(Lehrer) |
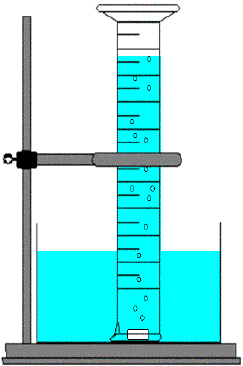
Der Zylinder
wird vom Lehrer ganz mit Wasser gefüllt, mit Parafilm verschlossen und kopfüber in die
Schüssel gestellt. In der Schale ist nur so viel Wasser, dass der
Inhalt des Zylinders noch hineinpassen würde. Standfestigkeit des
Zylinders mit Stativmaterial sichern. |
 |
Vorbereitung:
(Schülervariante) |
Der Zylinder
wird in die Wanne gelegt und ganz mit Wasser bedeckt. Dann wird der Fuß so
angehoben, dass die Öffnung am anderen Ende nie aus dem Wasser ragt.
Zylinder nun mit der Klammer wie in der Skizze befestigen. |
Durchführung1:
(Schüler) |
Zylinder so weit anheben, dass man die
Brausetablette schnell darunter schieben kann, dann schnell wieder bis zum Boden
absenken. |
| Beobachtung 1: |
Die Brausetablette entwickelt ein
Gas, das aus dem Zylinder Wasser verdrängt. |
| Auswertung 1: |
Das Gas ist Kohlenstoffdioxid. Notiere das Volumen:
V1=.................ml. |
| Aufgabe: |
Wenn man eine zweite Tablette
nach der ersten verwendet: welches Gasvolumen ist zu erwarten? |
| Durchführung2: |
Schiebe nach dem Ablesen eine zweite Tablette
unter den Zylinder. |
| Beobachtung 2: |
Wie Beobachtung 1. |
| Auswertung 2: |
Notiere das Gasvolumen jetzt:
Vg=.................ml
Berechne den Anteil, der auf die zweite Brausetablette zurückgeht:
V2=Vg-V1=...............ml. |
| Deutung: |
V2>V1, da sich von V1 ein großer Anteil in Wasser löst, bis eine
gewisse Sättigung erreicht ist. Deshalb kann fast das gesamte erzeugte V2
frei werden. |
| Entsorgung: |
Ausguss. |
| Quelle: |
van der Weer, W.; de Rijke, P. in
ChemKon Nr. 2/1994, 83-84. Mit dieser Zielsetzung: Walter Wagner, Didaktik
der Chemie, Universität Bayreuth. |
| Hintergrund: |
| Löslichkeiten in 100ml Wasser: |
| T [°C] |
V(Sauerstoff) |
V(Kohlenstoffdioxid) |
| 0° |
4.9 ml |
171 ml |
| 20° |
3.1 ml |
88 ml |
| 100° |
1.7 ml |
|
Lit.: Römpp, Chemielexikon, 9. Aufl., Thieme, Stuttgart 1994. |
| Allg. Hinweise: |
- Etwas CO2 wird durch
die Zylinderöffnung stets durch die Wasserströmung herausgedrückt,
verfälscht das Ergebnis jedoch nicht maßgeblich.
- Reaktionsgeschwindigkeit, Löslichkeit und Gasvolumen hängen von der
Temperatur ab. V2 wird aber stets größer sein als V1, so dass die
Höhe der Wassertemperatur für das Versuchsziel keine entscheidende Rolle
spielt.
- Der Versuchsaufbau verträgt auch eine dritte Tablette.
|
| Did. Hinweise: |
- Die Löslichkeit von CO2 erhält für Schüler erst dann
Bedeutung, wenn sie mit der anderer Gase verglichen wird. Bedeutsam für
das Leben ist der Luftbestandteil Sauerstoff (siehe das Experiment
Löslichkeit von
Sauerstoff in Wasser).
- Für die Ziele in N&T sind halbquantitative Aussagen ausreichend.
- Bei diesen Experimenten können fachspezifische Arbeitsweisen (Messen
von Gasvolumina, Fehlerbetrachtung) eingeübt werden.
|
| WWW: |
http://www.espere.net/Germany/water/dewatexpsolde.html Experiment zur
Temperaturabhängigkeit der Löslichkeit von Luft. |
Download als *.doc, 55k
Download als *.pdf, 404k
© Walter.Wagner
ät uni-bayreuth.de,
Stand:
23.03.09
|