| Zeitbedarf: |
 | Vorbereitung: 5min |
 | Durchführung: 3min |
|
| Ziel: |
"Wachstumsprozesse in der Chemie;
Es entsteht ein silbernes Bäumchen auf der Flüssigkeitsoberfläche. |
| Material: |
 | Becherglas (30ml) |
 | Standzylinder (30ml) |
 | Pasteurpipette mit Hütchen |
 | 10cm Platindraht (d = 0,5cm) |
 | 10cm Silberdraht (d = 0,5cm) |
|
 | Petrischale (d = 10cm) |
 | Netzgerät |
 | 2 Krokodilklemmen |
 | Spitzzange |
 | Handschuhe und Schutzbrille |
|
| Chemikalien: |
 |
Silbernitrat AgNO3
R 34-50/53 S26-50-60-61 |
 |
konz. Ammoniakwasser NH3
R 34-50 S26-36/37/39-45-61 |
|
  |
| Vorbereitung: |
Herstellung der ammoniakalischen Silbernitratlösung: 0,35g
Silbernitrat im Becherglas abwiegen und in 16,5ml dest. Wasser lösen.
Anschließend gibt man so lange Ammoniakwasser mit der Pasteurpipette hinzu,
bis sich der entstandene Niederschlag wieder auflöst. Zurechtbiegen der Kathode und Anode:
Mit der Spitzzange wird ein Ende des Silberdrahtes abgerissen, so dass eine
vielfache Spitze entsteht wie in Abb.1:

Abb.1: bearbeiteter Silberdraht
Nun werden Platin und Silberdraht wie in Abb.2 mit der
Spitzzange gebogen:
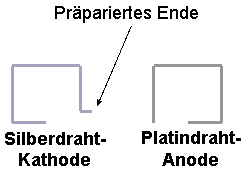
Abb.2 zurechtgebogene Kathode und Anode |
| Durchführung: |
In die Petrischale gibt man 16,5ml
der ammoniakalischen Silbernitratlösung. Anschließen der
Krokodilklammer: Den Minuspol an den Silberdraht und den Pluspol an den Platindraht. Silberkathode und Platinanode werden wie in Abb.3 angeordnet. Die
Silberkathode wird knapp unter die Flüssigkeitsoberfläche
platziert und die Spitze der Platinanode auf die
Flüssigkeitsoberfläche gelegt. Nun wird das
Netzgerät mit Gleichspannung angeschaltet (Erfahrungsgemäß haben 21V die
besten Ergebnisse geliefert).
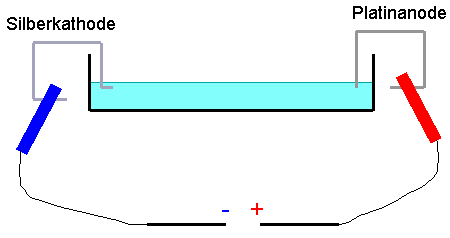
Abb.3 Versuchsaufbau |
| Beobachtung 1: |
Kurz nach dem Anschalten des Stroms
beginnt sich an der Kathode elementares Silber abzuscheiden und das
Silberbäumchen wächst in Richtung Anode. |
| Beobachtung 1: |
An der Platinanode kann die
Bildung von kleinen Gasbläschen beobachtet werden. |
| Entsorgung: |
Die Silbernitratlösung ist in den anorganischen Schwermetallabfall zu entsorgen. |
| Quelle: |
 | Roesky, H.W., Möckel, K.: Chemische Kabinettstücke, 1. Aufl., VCH,
Weinheim, New York, Basel, Cambridge, Tokyo, 1996, S.7, verändert
14.11.05 |
|
|
Hintergrund: |
Die Silber-Kationen wandern an
die Kathode und lagern sich als elementares Silber ab.
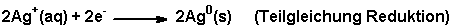
Durch weitere Anlagerung von Silberatomen bildet sich die fraktale Struktur des
Silberbäumchens.
An der Platinanode entsteht Sauerstoff:
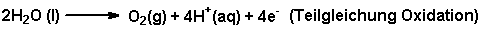 |
| Hinweise: |
 | Der Versuch klappt auch mit Büroklammern (Alltagsrelevanz) -
allerdings ist mehr Feingefühl nötig, um einen Silberbaum an der
Flüssigkeitsoberfläche zu erhalten. Wenn der Silberbaum auf der
Flüssigkeitsoberfläche und nicht am Boden der Petrischale wächst,
besitzt er mehr metallischen Glanz und wächst in ca. 3min statt in
10min. |
 | Vorsicht! Ammoniakalische Silbersalzlösungen dürfen nicht längere Zeit
aufbewahrt werden, da sich hochexplosives "Knallsilber" (Ag3N),
bilden kann. Man hält deshalb die Rückstände schwach salzsauer,
versetzt das Gemisch in einem Becherglas mit 5M Salzsäure und
reduziert mit Zink in Stangen zu metallischem Silber. |
|
| Did. Hinweise: |
 | Einsatzmöglichkeit in Themenbereichen Elektrochemie, Redoxreaktionen,
oder zur Demonstration des Unterschiedes zwischen einem Ion und einem
Element. |
|
| WWW: |
|