Hintergrund zu:
Herbstblatt
Indigocarmin (Dinatriumsalz der
3,3'-Dioxo-2,2'-biindolinyliden-5,5'-disulfonsäure,
Indigosulfonsaures Natrium) ist ein blaues Pulver, welches in
Wasser löslich ist [1].
Indigocarmin gehört in die Klasse der Carbonylfarbstoffe. In dieser
Klasse werden alle Farbstoffe, die mindestens zwei miteinander in
Konjugation stehende Carbonylgruppen besitzen, zusammengefasst. Weiter gehören auch die Anthrachinonfarbstoffe in diese Gruppe
[3]. Indigocarmin färbt Wolle und Seide direkt und die Färbung gibt ein
reineres Blau als beim Indigo, doch ist die Lichtechtheit etwas
geringer und es ist wasserlöslich. Indigocarmin ist sehr empfindlich gegen Oxidationsmittel
[1].
Lebensmitteltechnologisch ist Indigocarmin als E 132 zugelassen
zur Färbung von Zucker- und Süßwaren, Glasuren, Kunstspeiseeis und
Getränken. Weiterhin zur Färbung von kosmetischen Mitteln, Arzneimitteln und
Futtermitteln, in-vivo-diagnostisch zur Indigo-Probe nach LEPEHNE, mit der sich Leberparenchymschäden nachweisen lassen.
[2]
Zum Versuch
a) Die Farbänderung:
Es handelt sich um eine Redoxreaktion. Der
Farbstoff wird bei der oben durchgeführten Reaktion zum „Leuko“-Indigocarmin
(in wässriger Lösung goldgelb) reduziert (siehe Abb.1). Als Reduktionsmittel bzw.
Elektronenlieferant dient dabei Glucose, welche zu Gluconat
oxidiert wird. Das Grün entsteht aus
einer Mischung von reduziertem und oxidiertem Indigocarmin [5].
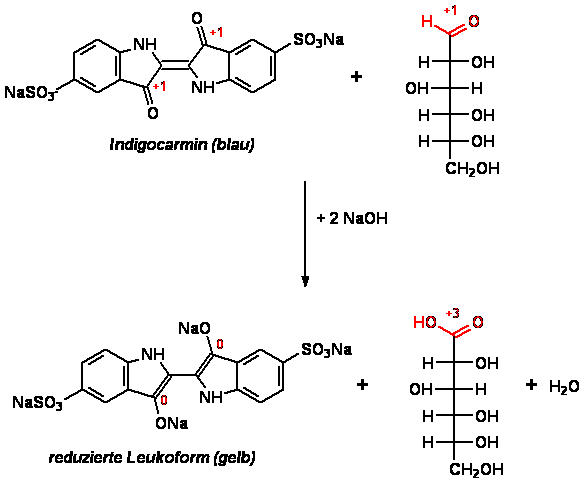
Abb. 1: Reduktion von Indigocarmin mit Glucose [5]
ACHTUNG: in Indigocarmin ist OZ(Carbonyl)=+2
ACHTUNG: in red. Form ist OZ(C)=+1
Dabei kommt es zu einer radikalischen Zwischenstufe, welche rot erscheint
(siehe Abb.2). Die Bildung könnte in Analogie zu der Chemie der
Chinhydrone ablaufen. In alkalischen Medien sind diese unbeständig und
zerfallen in ein Semichinon-Anion, unter Übertragung eines Elektrons auf
ein noch nicht reduziertes p-Benzochinon. Die Semichinon-Anionen zählen zu
den Radikal-Anionen und sind mesomeriestabilisiert. Das ungepaarte
Elektron ist über sämtliche C- und die beiden O-Atome delokalisiert [4].
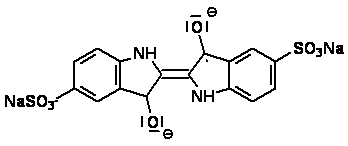
Abb. 2: Radikalanion [5]
b) Die Strukturbildung:
Zu strukturbildenden Phänomenen gibt es sehr viele Theorien.
Die stattfindenden Phänomene werden durch Unterschiede in der
Oberflächenspannung, Temperaturgradienten (Bernard-Effekt) oder
durch Dichtegradienten erklärt.
Eine gute Erläuterung der Theorien bietet die Dissertation von
Holger Kunz: " Prinzipien der Selbstorganisation":
http://docserver.bis.uni-oldenburg.de/publikationen/dissertation/2001/kunpri01/pdf/kap04.pdf
Für den Versuch "Herbstlaub" scheint die Ausbildung der konvektiven
Bewegung des Schlierenmusters vorrangig die Folge von entstehenden
Dichtegradienten zu sein, ohne große Beteiligung eines Gradienten in der
Oberflächenspannung. Dadurch entsteht die durch Fluktuation hervorgerufene
Musterbildung, nach dem von AVNIR und KAGAN beschriebenen Mechanismus
(Siehe Abb.2).
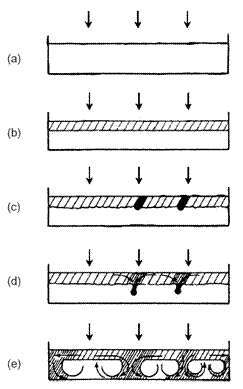
Abb. 3 Verlauf der Strukturbildung laut AVNIR und KAGAN [6]
Der Zustand in Abb.3a zeigt die Verhältnisse vor
dem Reaktionsstart, nach der Ansicht von AVNIR und KAGAN unabhängig von
der Art der Reaktion. Die Lösung ist homogen und in Ruhe.
Die Abb.3b zeigt den Reaktionsbeginn über der gesamten Oberfläche. Nach
ca. 1min treten Linien hoher Konzentration auf, was in Abb.3c durch
dunkle Färbungen veranschaulicht ist. Das Produkt sinkt an diesen Stellen in das Lösungsinnere ab
(Abb.3d). Für den Fall,
dass sich die Grenzfläche am Boden befindet, steigt das Produkt auf. Bei
relativ geringer Lösungstiefe (ca. 15mm) führen die absinkenden Produkte
eine hydrodynamische Rollenbewegung aus (Abb.3e).
Die Dynamik ist mit
dem Auge kaum wahrzunehmen, so dass man die Muster als "stehende
Strukturen" wahrnimmt. Im Zeitraffer ist die Bewegung zu erkennen.
[6]
Die unterschiedliche Färbung der Linien im Herbstblatt ist durch die
Reoxidation an Luftsauerstoff zu erklären (siehe Abb.4). Die Linien sind in der Lösung die
am weitesten oben gelegenen Schichten und kommen am ehesten mit der
Umgebung in Kontakt. Die Leukoform des Indikators wird wieder zurück
oxidiert zu Indigocarmin. Es liegt also eine Mischung von oxidierter und
reduzierter Form vor, welche je nach Mischungsverhältnis eine andere Farbe
geben. Die
Dynamik in der Flüssigkeit (z.B. durch unvermeidbare äußere Störungen)
verstärken den Effekt der inhomogenen Verteilung
der oxidierten Teilchen noch.
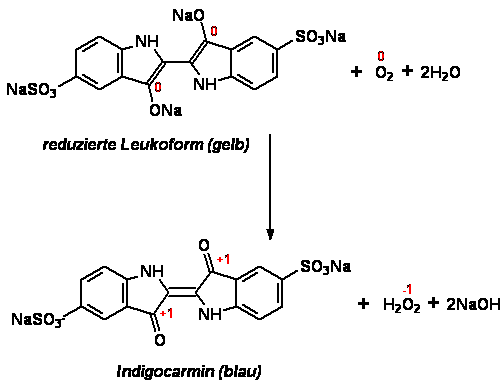
Abb. 4: Oxidation von Indigocarmin durch Luftsauerstoff [5]
Widersprechen strukturbildende Prozesse nicht dem 2. Hauptsatz der
Thermodynamik?
Wie kann die offensichtliche
Zunahme an Ordnung bei solchen spontanen Strukturbildungen, fraktalen Strukturen bzw. in der belebten Welt mit der vom 2. Hauptsatz
prophezeiten "zerstörerischen Kraft" der Entropie vereinbart werden? Die
Frage nach der Dissonanz zwischen dem 2. Hauptsatz der Thermodynamik und
der Entstehung des Lebens hat sich in den letzten Jahren zu einem rasant
wachsenden interdisziplinären Forschungsgebiet entwickelt.
Die grundsätzliche Entstehung solcher dissipativer Strukturen ist
durch den Entropieexport in die Umgebung zu erklären.
Man betrachtet also die Summe aus Systementropie und Umgebungsentropie und
erkennt, dass der 2. Hauptsatz in der Formulierung für Gesamtsysteme
erfüllt wird, wenn der Betrag der Systementropieabnahme durch den Betrag
der Umgebungsentropiezunahme überkompensiert wird. [6]
Literatur:
- Falbe, J., Regitz, M.: Römpp Chemie Lexikon, 9. Aufl., Georg Thieme
Verlag, Stuttgart, New York, 1991, S. 1965
-
http://www.omikron-online.de/cyberchem/cheminfo/7103-lex.htm,
22.02.06
-
http://www.dutly.ch/indigohtml/indigo1.html, 22.02.06
- Beyer, H., Walter, W.: Lehrbuch der organischen Chemie, 19. Aufl., S. Hirzel Verlag Stuttgart, 1981, S. 484
- organische Chemie, Uni Bayreuth
-
Kunz, H., Dissertation:
http://docserver.bis.uni-oldenburg.de/publikationen
/dissertation/2001/kunpri01/pdf/kap04.pdf, 22.02.06