|
Hintergrund zu:
Alkalimetalle in Wasser
Eigenschaften der Alkalimetalle Die
Alkalimetalle bilden eine homogene Gruppe außerordentlich reaktiver
Elemente, die beispielhaft die Ähnlichkeiten und Tendenzen illustrieren,
welche durch die periodische Klassifizierung erwartet werden können. Ihre
physikalischen und chemischen Eigenschaften lassen sich zwanglos auf der
Grundlage ihrer einfachen Elektronenkonfiguration ns1
interpretieren.
Es sind alles weiche, niedrig schmelzende, silbrig-weiße Metalle, die mit
kubisch raumzentrierten Gittern kristallisieren. [1]
| Element |
Lithium |
Natrium |
Kalium |
Rubidium |
Caesium |
| |
griech. lithos = Stein |
hebr. neter = Soda |
arab. al kalja = Pflanzen- asche |
lat. rubidus = dunkelrot |
lat. caesius = himmel- blau |
| Symbol |
Li |
Na |
K |
Rb |
Cs |
| relative Atommasse [u] |
6,941 |
22,9898 |
39,0983 |
85,4678 |
132,905 |
| Schmelzpunkt [°C] |
179,0 |
97,8 |
63,5 |
39,0 |
28,5 |
| Siedepunkt [C°] |
1340 |
883 |
760 |
696 |
708 |
| Härte |
abnehmend
 |
| Häufigkeit Erdkruste [%] |
6,0*10-3 |
2,63 |
2,41 |
2,9*10-2 |
6,5*10-4 |
| Flammen-färbung |
karminrot |
gelb |
violett |
dunkelrot |
hellblau |
| Reaktions-fähigkeit |
zunehmend
 |
| Stärke der Lauge |
zunehmend
 |
| Atomradius [pm] |
152 |
186 |
227 |
248 |
265 |
| EN nach Alfred/Rochow |
0,97 |
1,01 |
0,91 |
0,89 |
0,86 |
| 1.Ionisierungs-energie [eV] |
5,39 |
5,14 |
4,33 |
4,18 |
3,89 |
| Normal-potential [V]
|
-3,045 |
-2,714 |
-2,925 |
-2,925 |
-2,923 |
| Hydratations-enthalpie [kJ/mol] |
-508 |
-398 |
-314 |
-289 |
-256 |
Für die chemische Reaktivität ist vor allem die Höhe
der Elektronegativität und die Anzahl der Valenzelektronen
ausschlaggebend. Die Alkalimetalle besitzen nur 1 Valenzelektron, durch
dessen Abgabe sie die Edelgaskonfiguration erreichen können. Daher sind
die Ionisierungsenergien der Alkalimetalle besonders niedrig. Mit
abnehmender Elektronegativität steigt die Reaktivität der Alkalimetalle,
d.h. ihre Fähigkeit Elektronen abzugeben. [3][2] Die Reaktion mit Wasser
Entsprechend dem mit steigender Atommasse zunehmenden elektropositiven
Charakter nimmt die Reaktivität der Alkalimetalle gegenüber Wasser vom
Lithium zum Kalium zu. Lithium scheint bei diesem Versuch heftiger und
schneller zu reagieren als Natrium. Dies liegt wahrscheinlich an der
besonders hohen Hydratationsenthalpie des Lithiumions (dHR = -
508kJ/mol), welche die Bildung von Li+-Ionen in wässriger
Lösung und somit die Reaktion begünstigt. [4][2]
Bei dieser Reaktion kommt es zur Hydroxid- und Wasserstoffbildung,
sowie teilweise zur Verbrennung der Alkalimetalle.
Bildung von Hydroxiden
 | Lithium reagiert mit Wasser unter Bildung von Lithiumhydroxid, ohne zu schmelzen und ohne Entzündung
des Wasserstoffs. Dies ist wahrscheinlich auf die
höhere Reaktionsenthalpie von Lithium zurückzuführen:
 |
 | Natrium schmilzt bei der Reaktion (Schmelzpunkt 98°C), ohne dass der Wasserstoff
verbrennt (bei freier Beweglichkeit des Metalls):
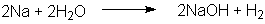 |
 | Kalium (sowie auch die schwereren Alkalimetalle) schmilzt und reagiert so heftig,
dass sich der gebildete Wasserstoff entzündet:
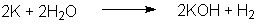 .
[4] .
[4] |
Nachweis der gebildeten Hydroxide
Bei der Reaktion mit Wasser bilden die
Alkalimetalle die basischen Hydroxide. Diese lösen sich in Wasser unter starker
Erwärmung und bilden Laugen. Mit einem Säure-Base-Indikator kann der Umschlag ins
basische nachgewiesen
werden.
In diesem Versuch wurde der Indikator Neutralrot verwendet (siehe Abb.1). [3]
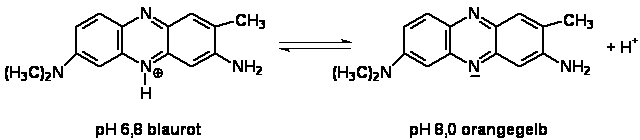
Abb.1: Neutralrot [7]
Wasserstoffentwicklung
Durch die stark negativen Normalpotentiale der Alkalimetalle wird Wasser [E(H+/H2) = – 0,42V bei pH=7] unter Bildung von Wasserstoff reduziert. Der aus dem Rahmen fallende hohe negative Wert des Normalpotentials
von Lithium ist wahrscheinlich auf die besonders hohe Hydratationsenthalpie des Lithiumions zurückzuführen, welche die Bildung von Li+-Ionen in wässriger
Lösung begünstigt.
Kalium zersetzt Wasser mit so großer Heftigkeit, dass die entstehende
Wärme genügt, um den gebildeten Wasserstoff zu entzünden. Es kann auch ein
Knall entstehen, wenn sich Wasserstoff mit dem Luftsauerstoff zu
Knallgas (H2:O2= 2:1) vermischt
(Knallgasreaktion).
Die starke Wasserstoffentwicklung und der Effekt des siedenden Wassers
bewirken die Bewegung des Metalls. [4]
Verbrennung des Alkalimetalls
Die Alkalimetalle bilden eine faszinierende Vielfalt von binären
Verbindungen mit Sauerstoff. Das vielseitigste ist Cäsium, das 9
Verbindungen mit Stöchiometrien vom CsO7 bis zum CsO3
bildet .
Werden die Metalle unter ausreichen Luftzufuhr verbrannt, so ist das
jeweilige Hauptprodukt vom eingesetzten Metall abhängig: Lithium bildet das
Oxid Li2O (und etwas Li2O2), Natrium gibt das Peroxid Na2O2 (und etwas Na2O),
wohingegen Kalium, Rubidium und Cäsium das Hyperoxid MO2 bilden. [1]
Lithiumoxid:
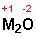
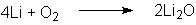
Natriumperoxid:
Gegenüber getrockneten Sauerstoff ist Natrium sehr beständig. So
kann es in vollkommen trockenem Sauerstoff geschmolzen werden (Smp. 98°C),
ohne sich zu entzünden. Bei Anwesenheit von Spuren Feuchtigkeit verbrennt
es dagegen beim Erwärmen an der Luft leicht mit intensiv gelber Flamme.
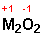

Mit oxidierbaren Stoffen kann es unter Explosion reagieren!
Kaliumhyperoxid:
K verbrennt beim Erhitzen an der Luft leicht mit intensiv violettem Licht
zu Hyperoxid.:
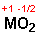
 .[5]
.[5]
Genaue Informationen sowie die MO-Schemata zu den Oxiden, Peroxiden, Hyperoxiden der Alkalimetalle
unter:
http://www.uni-bayreuth.de/departments/didaktikchemie/umat/alkalimet_overb/alkalimet_overb.htm
Peroxide und Oxide der Alkalimetalle Kalium, Rubidium und Cäsium
sind ebenfalls bekannt. Sie entstehen durch "kontrollierte Verbrennung", d.h. es darf nur die stöchiometrisch exakte Sauerstoffmenge zur
Verfügung gestellt werden. [6]
Verwendungsmöglichkeiten der Alkalimetalle
| Element |
Verwendung |
| Li |
 | Li gibt als Legierungsbestandteil Härte und Beständigkeit ;
z.B.
Bahnmetall der Deutschen Bundesbahn : Pb/Ca/Na/Li (0,04%).
|
 | Das Isotop 6Li wird zur Herstellung von 3H
verwendet |
 | Verwendung als Anode in Sekundärzellen |
 | Darstellung von Lithiumorganylen
|
 | Lithiumcarbonat hat in kleinen Dosen eine
antidepressive Wirkung |
|
| Na |
 | Verwendung zur Herstellung von Spezialmetallen,
z.B. Titan
|
 | Vitamin A -Herstellung und Indigoreduktion .
|
 | Zerstörung halogenorganischer Verunreinigungen in Flüssigkeiten.
|
 | Na/S-Hochleistungsbatterie für Elektrofahrzeuge.
|
 | Flüssiges Natrium dient aufgrund seiner guten Wärmeleitfähigkeit
als Kühlmittel in Kernreaktoren oder als Wärmeüberträger in
Kraftwerken |
|
| K |
 | 40K
ist radioaktiv und eignet sich zur Altersbestimmung von Mineralien
|
 | Hauptsächlich Verwendung der Salze als Düngemittel.
Die natürlichen Kaliumsilikate können von den Pflanzen nicht gut
genutzt werden. Zur Düngung werden daher bei intensiver
Bewirtschaftung KNO3 , K2SO4 oder KCl
verwendet. |
|
| Rb/Cs/Fr |
 | Rubidiumsalze wie Rubidiumchlorid oder Rubidiumbromid werden in
der Medizin als Schmerz- oder Beruhigungsmittel eingesetzt. |
 | 137Cs
dient wegen seiner kurzen Halbwertszeit (33 Jahre) zur Herstellung
technischer Gamma-Strahlenquellen.
|
 | Braunschweiger Cäsiumuhr (seit 1978) verwendet 133Cs
Derartige Uhren weichen in 10000 Jahren nur 0,3 Sekunden ab.
|
|
. [2][3]
Literatur:
- Greenwood, N.N., Earnshaw, A.: Chemie der Elemente, 1. korrigierter Nachdr.
d. 1. Aufl., VCH, Weinheim, Basel, Cambridge, New York, 1990, S. 83-111
-
http://www.seilnacht.com/Lexikon/19Kalium.htm, 22.02.06
-
http://www.uni-bayreuth.de/departments/didaktikchemie/
umat/alkalimet/alkalimetalle.htm. 22.02.06
-
http://www.cci.ethz.ch/vorlesung/de/al2/node2.html, 22.02.06
- Holleman, A.F., Wiberg, E.: Lehrbuch der Anorganischen Chemie, 81.-90.
Aufl., Walter de Gruyter, Berlin, New York, 1976, S. 707-740
-
http://www.uni-bayreuth.de/departments/didaktikchemie/
umat/alkalimet_overb/alkalimet_overb.htm, 22.02.06
- Falbe, J., Regitz, M.: Römpp Chemie Lexikon, 9. Aufl., Georg Thieme
Verlag, Stuttgart, New York, 1991, S. 2979
|
© Walter.Wagner ät uni-bayreuth.de,
Stand:
20.09.10
|