
Bild 25: Wassertropfen 1
Bild 7: Wassertropfen 2

Bild 15: Wassertropfen 3
Hintergrund:
Viele wasserstoffhaltige Verbindungen können Protonen an ein
Lösemittel wie Wasser abgeben und sich damit als Säure verhalten. Wasser
selbst ist zu einem sehr geringen Teil durch Autoprotolyse dissoziiert. Der
Vorgang wird gewöhnlich durch das Gleichgewicht:
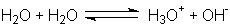
formal beschrieben. Jedoch sollte man im Gedächtnis behalten, dass
beide Ionen weitgehend solvatisiert werden und dass die Zeit, die ein Proton in
enger Bindung an irgendein Wassermolekül verbringt, in der Größenordnung von nur
etwa 10-13s liegt. Je nachdem, welcher Aspekt dieses Prozesses betont
werden soll, kann das Ion H3O+ (aq) als Oxonium, Wasserstoffion oder einfach als
solvatisiertes (hydratisiertes) Proton angesprochen werden.
Die Gleichgewichtskonstante für die Autoprotolyse ist gegeben
durch:
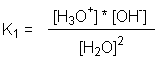
und da die Konzentration des Wassers als konstant betrachtet
werden kann, lässt sich das Ionenprodukt des Wassers als:
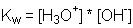
beschreiben.
Der Wert für Kw ist temperaturabhängig und beträgt
0,69*10-14mol2/L bei 0°C; 1,00*10-14mol2/L bei 25°C und 47,6*10-14mol2/L bei 100°C.
Daraus folgt, dass die Konzentration der Wasserstoffionen bei 25°C 10-7mol beträgt.
Säuren erhöhen diese Konzentration durch die Reaktion
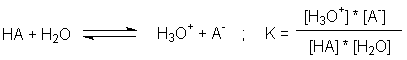 .
.
Das Symbol HA steht hier für eine beliebige Säure, die als Protonendonor
fungieren kann; es kann ein neutrales Molekül sein (z.B. H2S), ein
Anion (z.B. H2PO4-) oder ein Kation (z.B. [Fe(H2O)6]3+). Die
Konzentration der Wasserstoffionen wird gewöhnlich in Form des pH-Werts dargestellt.
In verdünnter Lösung kann die Konzentration der Wassermoleküle als konstant
betrachtet werden (bei 25°C 55,345mol/L), und die Dissoziation der Säure wird
gewöhnlich als:
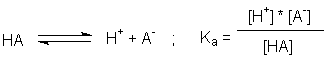
formuliert. [1]
Bildinformation:
Bild 25 und Bild 15 zeigen kondensierte Wassertropfen auf einer
Frischhaltefolie in 5facher Vergrößerung.
Bild 7 zeigt Wassertropfen auf einer Silikonplatte in 5facher
Vergrößerung.
Verwendung:
Die vorliegenden Bilder können für private und nichtkommerzielle Lehrzwecke
benutzt werden. Als minimaler Bildnachweis müssen das Copyright und der Urheber
in folgender Form vermerkt werden: © Kathrin Götz
Für Bildbestellungen in höherer Auflösung bitte E-Mail an folgende Adresse:
seminar-goetz ät gmx.de
Quellen:
Greenwood, N.N., Earnshaw, A.: Chemie der Elemente, 1. korrigierter Nachdr.
d. 1. Aufl., VCH, Weinheim, Basel, Cambridge, New York, 1990, S. 57f.
© Walter.Wagner ät uni-bayreuth.de,
Stand:
03.07.12