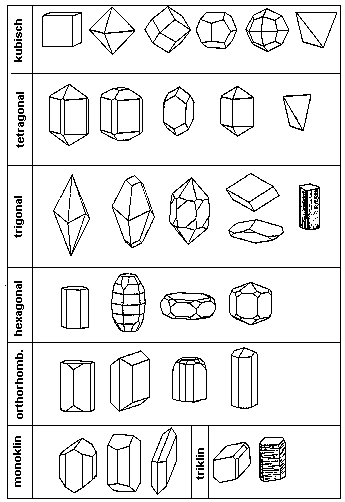
Kristalle Bild 30: Kristallgruppe aus rotem Blutlaugensalz Hintergrund:Der Begriff Kristall stammt ursprünglich von dem griechischen Wort „krýstallos“ = Eis ab. Bei dem bereits im antiken Griechenland betriebenen Bergbau wurden wahrscheinlich Quarz-Kristalle entdeckt, die für nicht geschmolzenes Eis gehalten wurden. Daher stammt die Bezeichnung „Krystall“, die sich im Laufe der Zeit zu „Kristall“ gewandelt hat. Die Kristallsysteme Trotz der Vielfältigkeit der Kristallformen lassen sich Kristalle aufgrund der Symmetrien ihrer Elementarzellen in nur sieben Kristallsysteme einordnen:
Die Grundstruktur eines Kristallsystems ist immer ein Prisma. Dieses ist der Körper des Systems mit der maximalen Symmetrie. Aus den Variationen der Verhältnisse der Seitenlängen untereinander sowie der Winkel resultieren die sieben Kristallsysteme (siehe Abb.1). [1]
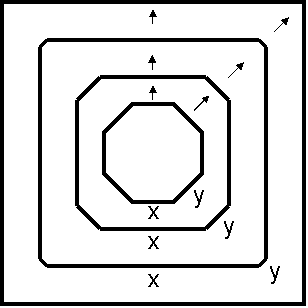
Das Kristallwachstum Das Kristallwachstum beginnt mit der geordneten Zusammenlagerung der Kristallbausteine, also von Atomen, Molekülen oder Ionen, die sich zunächst in einem ungeordneten Zustand befinden. Es entsteht ein sog. Kristallkeim. Das Medium ist entweder eine abkühlende Schmelze, eine übersättigte, sich abkühlende Lösung oder (wie bei der Sublimation) übersättigter Dampf. Diese Zustände werden erreicht, indem man entweder die Temperatur des Systems (z.B. der Schmelze, des Dampfraumes, der Lösung) senkt oder das Lösemittel verdunsten lässt. Grenzflächen wie Gefäßwände, Oberflächen anderer Kristalle oder Wollfäden, sowie andere Fremdpartikel erleichtern den Phasenübergang von der ungeordneten in die geordnete feste Phase. Die in der Lösung entstandenen Keime wachsen so zu großen Kristallen, wobei sich die einzelnen Bausteine Schicht für Schicht zu einem regelmäßigen, dreidimensionalen Gitter zusammenlagern. Atome, Ionen oder Moleküle werden durch die Gitterkräfte zusammengehalten. Die Teilchen berühren einander, und der freie Raum zwischen ihnen ist äußerst gering. Man spricht von dichten oder sogar von dichtesten Packungen. Die glatten Kristallflächen werden von Gitterebenen gebildet, und zwar von solchen, die besonders dicht mit Atomen besetzt sind und zwischen denen die relativ stärksten Bindungskräfte innerhalb der Struktur wirken. Glatte Gitterebenen sind energetisch günstiger als irgendeine unregelmäßige Anordnung der Atome an der Oberfläche. Kristalle wachsen sehr schnell: Um die 200 Schichten pro Sekunde entstehen. Dazu muss man wissen, dass ein Kristall mit der Kantenlänge von 1mm aus etwa 1020 Atomen aufgebaut ist. Das sind 100 Trillionen Bausteine, die sich in einem Salzkorn befinden! Große Kristalle wachsen auf Kosten der Kleinen. Denn verglichen mit den großen haben die kleinen Kristalle ein ungünstigeres Oberflächen-Volumen-Verhältnis, d.h. ihr chemisches Potential ist höher. Deshalb lösen sie sich eher auf. Das erkennt man auch, wenn man unterschiedlich große Zuckerkristalle (Streuzucker und Kandis) zusammen auflöst. Lässt man in einer gesättigten Lösung große Kristalle neben kleinen liegen, so verschwinden die kleinen nach einigen Tagen völlig. Das nutzt man bei der Züchtung von schönen Impfkristallen aus. Ein hohes chemisches Potential besitzen auch die Kanten und Ecken von Kristallen. Das erkennt man vor allem daran, dass beim Lösen eines Kristalls die Kanten zuerst abgerundet werden. Der Kristall fühlt sich "weich" an. Umgekehrt wachsen die Kanten und Ecken zuerst; deshalb fühlen sie sich beim wachsenden Kristall besonders scharf und spitz an. Ist die Konzentration der Bausteine in Lösung oder Gasphase wie sonst in den Schmelzen besonders hoch, kann man statt Flächenwachstum Kanten- und Spitzenwachstum beobachten. Würde ein Kristall in alle Richtungen gleich schnell wachsen, würden sich nur Kugeln bilden. Kristalle verfügen jedoch über richtungsabhängige Eigenschaften, beispielsweise die Wachstumsgeschwindigkeit. Es gibt die Regel, dass ein Kristall von den am langsamsten wachsenden Flächen begrenzt wird. Dies wird deutlich, wenn man von einem Achteck ausgeht:
Ist die Wachstumsgeschwindigkeit in der y-Richtung schneller, verschwinden diese Flächen schließlich, es bildet sich ein Würfel. Temperatur, Druck, Bindungsart der Teilchen untereinander und vorhandener Platz beeinflussen das Kristallwachstum. Da in der Natur unterschiedliche Wachstumsbedingungen herrschen, findet man hier vollkommen regelmäßige Kristalle sehr selten. An der Außenschicht des Kristalls bleiben jedoch an den Kanten und Flächen Bindungen offen, die irgendwie mit der Umgebung reagieren müssten. Im Folgenden werden einige Möglichkeiten genannt, wie sich verschiedene Kristallarten nach außen hin absättigen können:
Bildinformation:Bild 30 zeigt einen Riesenkristall aus rotem Blutlaugensalz. Verwendung: Quellen:http://www.mineralogie-erleben.de/jpg/ubersicht.jpg, Stand 18.11.05 Links:© Walter.Wagner ät uni-bayreuth.de, Stand: 03.07.12 |