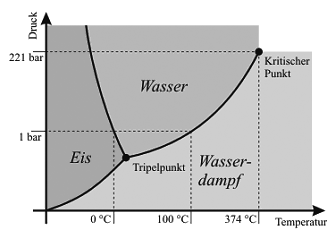
Eis Bild 2: Luftblasen in Eis Hintergrund:Die physikalischen Eigenschaften des Wassers sind stark von der Temperatur und dem Druck abhängig. Große Veränderungen der physikalischen Eigenschaften des Wassers treten auch ein, wenn im Wasser Stoffe gelöst werden. Vollkommen reines Wasser besitzt eine molare Masse von 18g/mol. Ebenso ist die Kompressibilität (Kompressionsmodul) temperaturabhängig. Mehrere Eigenschaften des Wassers sind besonders auf die Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen zurückzuführen und wegen dieser Verkettung gänzlich anders ausgeprägt als ohne diese zu erwarten wäre. Zu den Eigenschaften, die aus der Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen resultieren, zählen unter anderem der hohe Schmelz- und Siedepunkt des Wassers sowie die Dichteanomalie. Aggregatzustände Unter Normalbedingungen ist Wasser eine Flüssigkeit. Wasser ist der einzige uns bekannte Stoff, der in der Natur in allen drei Aggregatzuständen existiert. Das Phasendiagramm des Wassers zeigt, in wieweit der Aggregatzustand des Wassers von der Temperatur und dem Druck abhängt (siehe Abb.1). [1] Die kritische Temperatur des Wassers liegt bei 374°C, der kritische Druck bei 221,3bar und die kritische Dichte beträgt 0,315g/cm3. Beim Tripelpunkt des Wassers liegen flüssiges Wasser, Eis und Wasserdampf im nonvarianten Gleichgewicht nebeneinander vor. Als zugehörige Temperatur ist 0,01°C definiert worden. Der "wahre" Tripelpunkt liegt bei 0,0099°C und 6,11mbar.
Schmelz- und Siedepunkt Der Schmelz- und Siedepunkt des Wassers bei 1,013bar haben für die Menschheit eine so große Bedeutung, dass diese als Fixpunkte für die Celsius-Temperatur-Skala festgelegt wurden. Wasser siedet unter Normalbedingungen (25°C und 1,013bar) bei 100°C und erstarrt bei 0°C. Eis von 0°C hat eine Dichte 0,917g/cm3. Das Litergewicht des Wasserdampfes beträgt unter Normalbedingungen (0°C und 1,013bar) 0,597g und seine Dichte beträgt 0,462g/cm3 (wenn die Dichte von Luft von 0°C gleich 1g/cm3 gesetzt wird). [2] Wasser hat einen relativ hohen Siedepunkt. Zum Vergleich: Methan hat dieselbe molare Masse und siedet unter Normaldruck bereits bei -161°C. Falls Wasser den aus der molaren Masse abzuleitenden Gesetzmäßigkeiten entspräche, so müsste es bei Raumtemperatur unter Normaldruck als Gas vorliegen. Dass dies nicht so ist, lässt sich dadurch erklären, dass zusätzlich zu den intramolekularen Kräften auch die Wasserstoffbrückenbindungen überwunden werden müssen. Dichteanomalie Wasser hat unter Normaldruck seine größte Dichte von 1,000g/cm3 bei rund 4°C und zeigt damit eine Dichteanomalie. Die Dichteanomalie des Wassers besteht darin, dass es sich unterhalb von 4°C trotz weiterer Temperaturverringerung wieder ausdehnt. Der Grund der Anomalie des Wassers ist die Verkettung der Wassermoleküle über Wasserstoffbrückenbindungen. Im festen Aggregatzustand – hier Eis – wird normalerweise eine hohe Fernordnung durch Ausbildung eines Kristallgitters im Zuge der Kristallisation erreicht. Dadurch ist die resultierende Struktur im festen Zustand größer als bei beweglichen Molekülen. Dies ist ein fortschreitender Vorgang, das heißt, dass schon im flüssigen Zustand so genannte Cluster aus Wassermolekülen vorhanden sind. Bei 3,98°C ist der Zustand erreicht, bei dem die einzelnen Cluster das geringste Volumen einnehmen und damit die größte Dichte haben. Wenn die Temperatur weiter sinkt, wird durch einen stetigen Wandel der Kristallstrukturen mehr Volumen benötigt. Wenn die Temperatur steigt, benötigen die Moleküle wieder mehr Bewegungsfreiraum und das Volumen steigt. Die sprunghafte Volumenzunahme des Wassers um ca. 9% beim Gefrieren und die dabei auftretenden großen Kräfte bewirken ein Bersten von Rohren, Mauerwerken, Straßenbelägen und Aufschüttungen, was man als Frostsprengung bezeichnet. Zur Vorsorge werden die Gartenleitungen im Winter entleert, Mauerwerke gestrichen und Aufschüttungen so angelegt, dass das Wasser abfließen kann. Bauwerke werden so angelegt, dass sich Wasser unter ihnen entweder nicht ansammeln oder nicht gefrieren kann. [1] Bildinformation:Bild 2 zeigt in einem Eiswürfel eingeschlossene Luftbläschen in 5facher Vergrößerung. Verwendung: Quellen:
© Walter.Wagner ät uni-bayreuth.de, Stand: 03.07.12 |