Hintergrund zu:
Kaltes Licht
Es gibt verschiedene Arten von kaltem Licht. Einige Beispiele
werden im Folgenden erklärt.
Biolumineszenz:
Als Biolumineszenz bezeichnet man die Fähigkeit mancher Bakterien,
Pilze und Tiere, Licht zu erzeugen. Unter den Tieren sind
leuchtende Vertreter aus allen großen Tierstämmen bekannt. Durch
Leuchtzellen oder komplizierte Leuchtorgane können zahlreiche
Lebewesen Licht aussenden. Dabei reagieren in den meisten Fällen
zwei chemische Substanzen miteinander. Die Leuchtstoffe werden
auch als Luciferine bezeichnet, welche mit Hilfe von Adenosintriphosphat (ATP) und durch Luciferasen zum Leuchten
angeregt werden. Besonders bekannt sind die Leuchtkäfer (Photimus
pyrallis und Lamphiris noctiluca), welche im Volksmund oft auch als
Glühwürmchen bezeichnet werden. Andere Lebewesen wie die
Meeresleuchten (Noctiluca milaris) zeigen ebenfalls helle
Biolumineszenzen. Diese Fähigkeit wird von den Tieren zur
Kommunikation und zur Beutejagd verwendet.
Chemolumineszenz:
Bei der Chemolumineszenz werden wie bei allen Lumineszenzprozessen
Elektronen auf ein energetisch höheres Energieniveau gehoben. Beim
Zurückfallen in den Grundzustand, wird Energie in Form von
sichtbarem Licht abgegeben. Die energetische Anregung erfolgt bei
der Chemolumineszenz durch chemische Energie.
Elektrolumineszenz:
Unter diesem Begriff, versteht man das Aufleuchten bestimmter
Substanzen wie beispielsweise Zinksulfid mit Kupferzusatz
innerhalb eines elektrischen Wechselfeldes. Als
elektrolumineszierende Lichtquelle kann prinzipiell ein
Plattenkondensator verwendet werden, dessen Dielektrikum eine
entsprechende Menge eines Leuchtpigmentes enthält.
Fluoreszenz:
Als Fluoreszenz bezeichnet man das Mitleuchten mancher Stoffe wie
Fluorescein bei der Bestrahlung mit Licht. Dabei hat das
ausgesandte Licht gewöhnlich eine größere Wellenlänge (andere
Farbe) als das erregende Licht. Mit der Erregerstrahlung erlischt auch
unmittelbar die Fluoreszenzstrahlung.
Phosphoreszenz:
Phosphoreszenz ist die Eigenschaft mancher Substanzen, nach der
Bestrahlung mit sichtbarem bzw. ultraviolettem Licht eine gewisse
Zeit nachzuleuchten. Derartige Stoffe nehmen die Lichtenergie auf
und strahlen sie anschließend in Form von längerwelligem Licht
mehr oder weniger schnell wieder aus. Phosphoreszierende Stoffe,
welche oftmals auch als „Phosphore“ bezeichnet werden, sind meist
Kristalle, deren Gitterstruktur durch ganz geringe Beimengungen
eines Fremdstoffs gestört ist. Solche Stoffe sind unter anderen
die stark geglühten und mit geringen Mengen von Schwermetallsalzen
versetzten Sulfide der Erdalkalimetalle und des Zinks.
Röntgenlumineszenz:
Die Röntgenlumineszenz ist der Fluoreszenz sehr ähnlich, jedoch wird hier nicht mit
sichtbarem bzw. ultraviolettem Licht angeregt. Stattdessen bedient
man sich der von Wilhelm Conrad Röntgen entdeckten
Röntgenstrahlung (X-Strahlen). Dabei werden verschiedene
Substanzen, wie beispielsweise stark geglühtes Zinksulfid, zum
Leuchten angeregt.
Sonolumineszenz:
Als Sonolumineszenz bezeichnet man die Eigenschaft mancher Stoffe,
bei der Einwirkung von Ultraschallwellen Energie in Form von
sichtbarem Licht freizusetzen. Besonders konzentrierte
Schwefelsäure soll ein gut erkennbares Leuchten zeigen, wenn diese
mit Argon- oder Stickstoffgas überschichtet in einem
Ultraschallbad vorliegt.
Thermolumineszenz:
Als Thermolumineszenz bezeichnet man die Eigenschaft mancher
Substanzen, bei der Einwirkung von Wärme diese als Energie
aufzunehmen und anschließend in Form von Lichtenergie wieder
abzugeben. Unter anderem wurde Thermolumineszenz beim starken
Erhitzen von Natriumchlorid, welches zuvor mit Alpha-Strahlung
bestrahlt wurde, beobachtet.
Tribolumineszenz:
Unter Tribolumineszenz versteht man das Auftreten einer „kalten“
Lichtemission beim zerbrechen oder zerreiben bestimmter
kristalliner Stoffe. Auch durch einen thermischen Schock wie z.B.
beim Abkühlen in flüssiger Luft, kann Tribolumineszenz auftreten.
[1]
Nähere Informationen zu Fluoreszenz
Wird einem Molekül Energie in Form von elektromagnetischer
Strahlung zugeführt, so wird diese Energie im Molekül
transformiert, das heißt in andere Energieformen umgewandelt. Je
nach Energiegehalt der elektromagnetischen Strahlung erfolgt dies
auf unterschiedliche Weise.
Strahlung niedriger Energie, wie z. B. Mikrowellen- oder
Infrarotstrahlung wird in mechanische Energie, in
Rotationsbewegungen und Schwingungen des Moleküls umgewandelt. Wir
nutzen dies im Infrarotgrill und in der Haushaltsmikrowelle.
Ist der Energiegehalt der Strahlung größer (sichtbares Licht,
UV-Licht), so werden Elektronen aus ihren Orbitalen
herausgelöst und in leere, unbesetzte Orbitale mit höherem
Energiegehalt gehoben.
Dieser angeregte Zustand ist energetisch ungünstig und nicht
stabil. Bereits nach 0,00000008s fällt das Elektron wieder in
sein ursprüngliches Orbital zurück, wobei die Energie meist wieder
als Schwingungsenergie frei wird.
Wir können diesen Prozess täglich beobachten. Fällt Licht auf
einen Gegenstand, so werden je nach Molekülstruktur bestimmte
Wellenlängen absorbiert und in Wärme umgewandelt. Was wir sehen,
ist die reflektierte Reststrahlung, deren Farbe nun der
Komplementärfarbe des absorbierten Lichtes entspricht. Das alte
Sprichwort "Nachts sind alle Katzen grau" findet hier seine
tiefere Bedeutung, denn ohne Licht keine Farbe!
Einige Moleküle haben auf Grund ihrer Struktur nur sehr
eingeschränkte Möglichkeiten, Anregungsenergie in
Schwingungsenergie umzuwandeln. In diesen Molekülen fallen die
Elektronen aus dem Orbital mit höherem Energiegehalt direkt in ihr
ursprüngliches Orbital zurück. Die Energie wird als
elektromagnetische Strahlung frei. Diese freiwerdende
elektromagnetische Strahlung liegt meist im sichtbaren Bereich des
Spektrums und wird als Fluoreszenzlicht bezeichnet, die
Erscheinung als Fluoreszenz. Die Emission von Fluoreszenzlicht
erfolgt vom angeregten Zustand mit der geringsten Energie (S1)
aus. Das Fluoreszenzlicht ist daher immer langwelliger als das
eingestrahlte Anregungslicht. Eine Übersicht über diese Prozesse
und Zusammenhänge gibt das Jablonski Diagramm (siehe Abb.1). [2]
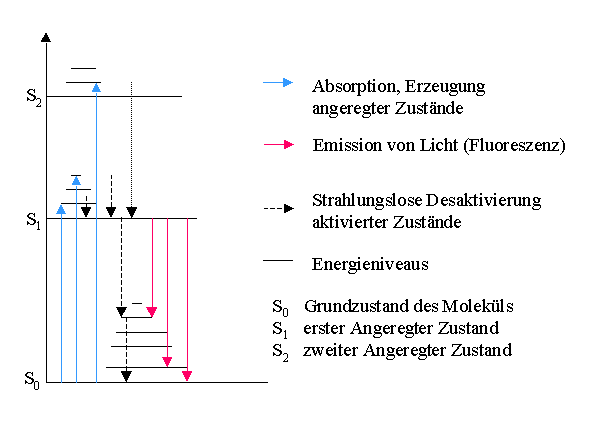
Abb.1: Jablonski Diagramm [2]
Literatur:
-
http://geoleoedocs.sub.uni-goettingen.de:8080/dspace/bitstream/gledocs-101/1/Lumineszenz_Spektakulaere_und_nuetzliche_Eigenschaft_von_Mineralen.pdf,
Stand 25.01.10