Hintergrund zu:
Fruchteisbecher
Ein Stoff, der eine Reaktion bewirkt, ohne dass er sich
verändert oder verbraucht wird, ist ein Katalysator. Biologische
Katalysatoren nennt man Enzyme.
Die im Blut befindlichen
Enzyme lassen sich in zwei Hauptgruppen einteilen: Hydrolasen und
Desmolasen.
Hydrolasen spalten chemische Bindungen, indem sie Wasser zwischen
die Bindungsstellen einlagern oder es entfernen. Dazu gehören
unter anderem die Eiweiß spaltenden Enzyme Pepsin und Trypsin.
Desmolasen regeln verschiedene Redoxvorgänge. Die Desmolase, die im Blut enthalten ist und speziell auf Wasserstoffperoxid
(H2O2) einwirkt, heißt Katalase. Katalase ist ein Fe3+-haltiges Enzym. Die Natur bedient
sich dieses Katalysators zum raschen Abbau des giftigen
Wasserstoffperoxids, welches im lebenden Organismus durch
eine Vielzahl von Reaktionen mit Sauerstoff erzeugt wird.
Für den Ablauf des katalytischen Zerfalls von Wasserstoffperoxid
in Anwesenheit von Fe3+-Ionen kennt man heute zwei
Mechanismen, die auf einem wechselseitigen Redoxübergang Fe(III)/Fe(V)
(Kremer-Stein-Mechanismus) oder Fe(III)/Fe(II) (Haber-Weiss-Mechanismus)
beruhen.
Kremer-Stein-Mechanismus:
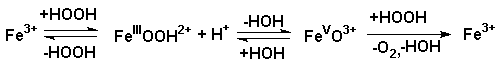
Haber-Weiss-Mechanismus:
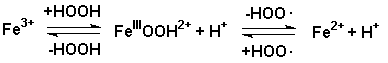 Startreaktion
Startreaktion
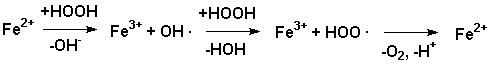 Reaktionskette. [1]
Reaktionskette. [1]
Literatur:
-
http://www.cci.ethz.ch/mainmov.html?exchap=-1&picnum=-1&language=0&expnum=193&ismovie=-1&exlist=80+81+86+87+109+119+176+192+193+-1,
Stand 11.11.05