Hintergrund zu:
Buntes Feuerwerk
Grundsätzlich unterscheidet sich eine normale Verbrennung
nur wenig von der eines pyrotechnischen Satzes. Dennoch gibt es
Unterschiede, beispielsweise die Verbrennungsgeschwindigkeit oder auch die
Komplexität, in der die Reaktionen ablaufen. So werden auch in pyrotechnischen Sätzen
Brennstoffe (Reduktionsmittel) durch ein Oxidationsmittel, meist
noch unter Anwesenheit weiterer Stoffe, wie Katalysatoren, oxidiert. Abhängig ist das Abbrandverhalten
von Feuerwerkssätzen auch noch von anderen Faktoren, wie der Partikelgröße,
den Abbrandbedingungen, der Temperatur, dem Druck oder der Verdämmung und, in wenigen Fällen, auch
von der
Art der Entzündung. [1]
Die Chemikalien, die in den Sätzen der Feuerwerkerei Verwendung finden,
lassen sich in drei Gruppen einteilen. Erstens die
Oxidationsmittel, zweitens die Brennstoffe und drittens die Zusatzstoffe,
die sich wiederum in viele kleinere Gruppen aufspalten lassen (z.B. Farbgeber, Bindemittel, Katalysatoren).
[1]
Oxidationsmittel
Oxidationsmittel machen das Geheimnis
pyrotechnischer Sätze aus. Sie sorgen dafür, dass die Feuerwerkssätze
unabhängig vom Luftsauerstoff reagieren können, indem sie den Sauerstoff
für die Verbrennung zur Verfügung stellen. Damit die einzelnen Komponenten
eines Feuerwerkssatzes auch wirklich miteinander reagieren, werden noch
weitere verschiedene Anforderungen an die Oxidationsmittel gestellt. So
dürfen die Oxidationsmittel z.B. nicht hygroskopisch sein und müssen ihren Sauerstoff schon
bei verhältnismäßig niedrigen Temperaturen abgeben. Diese Bedingungen
erfüllen zumeist Metallsalze sauerstoffreicher, anorganischer Säuren, wie
Nitrate oder Perchlorate. [1]
Brennstoffe
Der Brennstoff hat die Aufgabe, während der Reaktion in Verbindung mit
einem Oxidationsmittel für eine hohe Temperatur zu sorgen. Eine hohe
Temperatur ist dafür notwendig, dass z.B. farberzeugende Stoffe zum
Leuchten angeregt werden. Je höher die Temperatur, desto größer ist auch
die Lichtausbeute, welche jedoch eine Grenze von 10% der Gesamtenergieabgabe
nicht überschreitet. Zu den Brennstoffen zählen Metalle, wie Magnesium,
Titan oder Eisen; Nichtmetalle, wie Schwefel oder Kohlenstoff und
organische Verbindungen, wie Schellack oder PVC. [1]
Bei den Brennstoffen und den Oxidationsmitteln sollte man allerdings auf das
chemische Gleichgewicht achten. D.h. in einer Mischung darf nicht
mehr sauerstoffliefernde Substanz vorhanden sein, als zur
Verbrennung der brennbaren Substanz nötig ist, da ein solcher
Überschuss die Reaktion behindern würde. Das richtige Verhältnis
kann man anhand der Reaktionsgleichung berechnen. Ein
perfektes Gleichgewicht bedeutet aber nicht, dass eine Mischung auch
gut funktioniert. Einen großen Einfluss auf das Gelingen der
Reaktion hat auch die Partikelgröße. Bei der Feuerwerksmischung Grün kommt die
heftige Reaktion nur zustande, wenn man mit Zinkpulver arbeitet.
Bei Einsatz von Zinkbrocken würde die Reaktion nur sehr langsam
und weniger exotherm ablaufen. Je feiner das Pulver ist, desto
größer ist seine Oberfläche und desto besser kann es
reagieren. Eine zu geringe Körnchengröße
aber kann hierbei heftige Explosionen auslösen! Ein Kilo Holz in Form eines Würfels wird nicht brennen,
wenn man ein brennendes Streichholz daran hält, ein Kilo Holzwolle
dagegen schon! Man sollte sich also im Klaren sein, welche Reaktion man
erreichen will - eine Wunderkerze mit Eisenstaub herzustellen
ergibt keinen Sinn, sie würde mit hellem Aufleuchten in zwei
Sekunden verbrennen; mit grobem Eisenpulver dagegen brennt sie
ruhig und funkelt vor sich hin.
Für ein Blitzlichtpulver, das schlagartig verbrennen soll, wird
man also immer staubfeine Bestandteile verwenden. [2]
Zusatzstoffe
Alle weiteren Stoffe, die in einem pyrotechnischen Satz enthalten sind,
bezeichnet man als Zusatzstoffe. Dies können beispielsweise Farbgeber, Katalysatoren,
Inhibitoren oder Bindemittel sein.
Informationen zu Farbgebern:
Eine Flamme kann
durch Zugabe von Metallsalzen eingefärbt werden. Die Farberscheinung ist
darauf zurückzuführen, dass die Valenzelektronen der Metalle durch die
Brennerflamme in einen angeregten Zustand versetzt werden. Dieser
angeregte Zustand ist aber sehr instabil. Beim Zurückfallen auf den
Grundzustand wird der zwischen den beiden Schalen vorherrschende
Energieunterschied in Form von Lichtenergie frei. [3]
Was die Farbe des Feuerwerkes angeht, muss man wissen, was man erreichen will. Nimmt man eine Mischung aus
Schwefel, Kaliumnitrat, Strontiumnitrat und Natriumnitrat, so wird diese
Feuerwerksmischung
immer gelb verbrennen, da das Natrium selbst in einem sehr intensivem Gelb
verbrennt und so
das Rot des Strontiums und das Violett des Kaliums völlig überdeckt. Gibt
man zu einer Mischung von Strontiumnitrat und Schwefel noch Magnesium
dazu, wird diese Mischung viel schwächer rot verbrennen, da das Magnesium
ein sehr helles, weißes Licht abgibt und so das Rot zum Teil verblasst.
Alle Farben, außer Blau, lassen sich sehr einfach erzeugen. Der Einsatz von
Kupfernitrat erzeugt allerdings keine blaue Farbe in pyrotechnischen
Mischungen. Um Blau zu erzeugen, muss man verschiedene Kupfersalze in derselben Mischung verwenden, und genaue Mengen organischer Chlorverbindungen
zufügen, da die blaue Färbung nur dann entsteht, wenn während des
Verbrennens neben Kupfer auch Chlor vorhanden ist. In diesen
Mischungen herrscht ein feines Gleichgewicht vor, das man nicht
errechnen kann. [4]
Zum Versuch
Feuerwerkschemie läuft nicht schulbuchmäßig sauber ab, sondern es
existieren viele Nebenreaktionen. Die Reaktionsabläufe werden durch die Stöchiometrie der Edukte
stark beeinflusst.
Rotes Feuerwerk:
Strontiumnitrat
wirkt als Farbgeber und Oxidationsmittel; Kaliumchlorat wirkt als
Oxidationsmittel. Schwefel, Antimon und Zucker wirken als Brennstoffe.
Die Umsetzungen könnten wie folgt verlaufen:
Kaliumchlorat zersetzt sich ab 400°C in einer Disproportionierungsreaktion
zu Kaliumperchlorat, Kaliumchlorid und Sauerstoff:
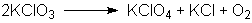
Ob diese Disproportionierung beim Verbrennungsvorgang tatsächlich nötig
ist bzw. abläuft, bleibt offen. Kaliumperchlorat zersetzt sich weiter zu
Sauerstoff und Kaliumchlorid:
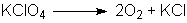
Kaliumchlorat reagiert
mit
Schwefel zu Kaliumchlorid und Schwefeldioxid:
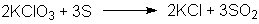
Der Zucker wird oxdiert:
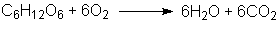
Antimon verbrennt zu Antimonoxid:
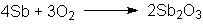
In der Schmelze mit Schwefel bilden sich je nach stöchiometrischem
Verhältnis auch Antimonsulfide:
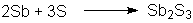
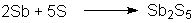
Zudem finden ebenfalls Reaktionen von Nitrat mit Schwefel bzw. Kohlenstoff
statt (siehe Gelbfeuer).
Grünes Feuerwerk:
Bariumnitrat wirkt als Farbgeber und Oxidationsmittel, Zinkpulver
wirkt als Brennstoff und
Farbgeber, Ammoniumchlorid und Ammoniumnitrat wirken als
Oxidationsmittel und Energielieferanten.
Die Umsetzungen könnten wie
folgt verlaufen:

Ammoniumchlorid
zersetzt sich durch thermische Dissoziation zu HCl und NH3. Der
Ammoniak verbrennt zu Wasser und Stickstoff (exotherm).
Ammoniumnitrat ist für sich genommen schon ein Explosivstoff, es zerfällt in einer
Synproportionierung (stark exotherm) zu Stickstoff, Wasser und Sauerstoff:

Der entstehende Sauerstoff dient wiederum als Oxidationsmittel.
Gelbes Feuerwerk:
Die Zusammensetzung entspricht im wesentlichen
der von Schwarzpulver.
Kaliumnitrat wirkt als Oxidationsmittel, Holzkohle und Schwefel als
Reduktionsmittel und Natriumacetat als Farbgeber. Natriumnitrat wäre hier
nicht geeignet weil es zu hygroskopisch ist.
Die Umsetzungen
könnten wie folgt verlaufen:
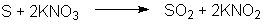
Kaliumnitrit wird unter den gegebenen Reaktionsbedingungen weiter
reduziert zu Kaliumcarbonat, Stickstoff und Kohlenmonoxid:
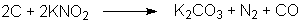
Kaliumnitrit reagiert mit Schwefel u.a.
zu Distickstoffoxid, das in N2 und O2 zerfällt.
Eventuell intermediär auftretendes N2O
reagiert mit CO zu Stickstoff und Kohlendioxid:
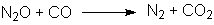 [3]
[3]
Weißes Feuerwerk:
Kaliumchlorat wirkt als Oxidationsmittel. Schwefel und
Aluminium wirken als Reduktionsmittel und als Brennstoff:
Die Umsetzungen könnten wie folgt verlaufen:
Kaliumchlorat kann mit
Schwefel zu Kaliumchlorid und Schwefeldioxid reagieren:
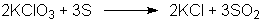
oder Kaliumchlorat reagiert mit Aluminium zu Kaliumchlorid und
Aluminiumoxid:
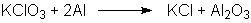
Literatur:
- http://www.pyroweb.de/WissenChemie.php,
Stand 22.02.06
-
http://www.uni-bayreuth.de/-departments/didaktikchemie/umat/
feuerwerk/feuerwerk.htm,
Stand 22.02.06
- http://dc2.uni-bielefeld.de/dc2/gefahr/feue-was.htm,
Stand 22.02.06
- http://www.pyro-partner.de/feuerwerk/fwrk_chemie.html,
Stand 22.02.06
Links: