Hintergrund zu:
Farbiges Feuer mit Wasser
Der Versuch „Farbiges Feuer mit Wasser“ funktioniert wie
die meisten pyrotechnischen Mischungen nach dem Prinzip einer
Redoxreaktion. Das heißt, ein Stoff gibt Sauerstoff ab, wird
also reduziert, während ein anderer Stoff Sauerstoff aufnimmt,
also oxidiert wird (historische Sichtweise). Da eine pyrotechnische Mischung allerdings
selten aus nur zwei Komponenten besteht, sind die Reaktionen, die
in ihr ablaufen, doch recht kompliziert. Die meisten Mischungen
bestehen aus einer sauerstoffliefernden Substanz und einem leicht
brennbaren (oxidierbaren) Stoff. Allerdings muss man auf das
chemische Gleichgewicht achten. D.h. in einer Mischung darf nicht
mehr sauerstoffliefernde Substanz vorhanden sein, als zur
Verbrennung der brennbaren Substanz nötig ist, da ein solcher
Überschuss die Reaktion behindern würde. Das richtige Verhältnis
kann man anhand der Reaktionsgleichung berechnen. Aber ein
perfektes Gleichgewicht bedeutet nicht, dass eine Mischung auch
gut funktioniert - manchmal muss man viele Versuche durchführen,
bevor man Erfolg hat. Es gibt noch mehr Faktoren, die eine Rolle
spielen, z.B. die Partikelgröße. In diesem Versuch kommt die
heftige Reaktion nur zustande, wenn man mit Zinkpulver arbeitet.
Bei Einsatz von Zinkbrocken würde die Reaktion nur sehr langsam
und ohne Explosion ablaufen. Je feiner das Pulver, desto
größer ist auch seine Oberfläche und desto besser kann es
reagieren, wobei eine zu geringe Körnchengröße
heftige Explosionen auslösen kann. Ein Kilo Holz in Form eines Würfels wird nicht brennen,
wenn man ein brennendes Streichholz daran hält, ein Kilo Holzwolle
dagegen schon. Trotzdem sollte man wissen, welche Reaktion man
erreichen will - eine Wunderkerze mit Eisenstaub herzustellen
ergibt keinen Sinn, sie würde mit hellem Aufleuchten in zwei
Sekunden verbrennen, mit grobem Eisenpulver dagegen brennt sie
ruhig und funkelt vor sich hin.
Für ein Blitzlichtpulver, das schlagartig verbrennen soll, wird
man also immer staubfeine Bestandteile verwenden.
Zum Versuch
Durch das Wasser wird die stark exotherm ablaufende Redoxreaktion
zwischen dem Zinkstaub und dem Nitrat (Sauerstofflieferant)
initiiert. Wegen der großen Oberfläche des Zinkstaubes kann die
Reaktion sehr schnell und heftig (unter Wärmeabgabe) ablaufen.
Es gibt zwei Erklärungen für den Ablauf der Reaktion:
Es kommt
zunächst zur Bildung von atomarem Wasserstoff, einem Radikal. Man spricht
vom Wasserstoff "in statu nascendi" (lateinisch für "im Zustand der
Geburt"). Das Wasserstoffradikal reagiert - bevor er sich mit einem
anderen Radikal zum Wasserstoffmolekül H2 verbindet - in einer
Folgereaktion mit Nitrat zum Nitrit.
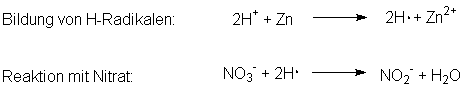
Es kann dann zu weiteren Reaktionen kommen, wobei Stickstoff (N2)
und Stickstoffdioxid (NO2) entstehen können.
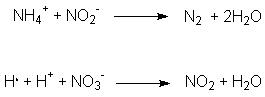 usw. [1]
usw. [1]
Nach einer anderen Erklärung stammen die Elektronen aus einer direkten
Reaktion zwischen dem Nitrat und dem Zink, das dabei oxidiert wird.
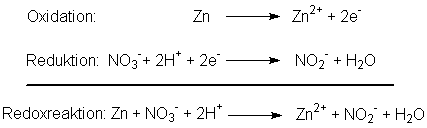
Die Wasserstoffionen haben nach diesem Reaktionsmodell nur die Aufgabe,
den Sauerstoff aus dem Nitrat zu "entsorgen".
Daneben überträgt das Zink auch Elektronen auf das Wasser bzw. auf
die Wasserstoff- oder Ammoniumionen, wobei Wasserstoff und Ammoniak
entstehen:
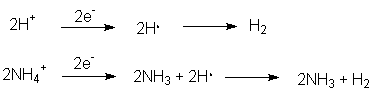
Diese Reaktionen laufen an der Oberfläche des Metalls ab. Es handelt sich
um eine chemische Zersetzung des Metalls, also um die
Korrosion von Zink in sauren Nitratlösungen. Ammoniumchlorid beschleunigt
den Vorgang und verdampft dabei unter Zersetzung.
Die Dämpfe bestehen aus NO2, NH3, H2O
und NH4NO2.
[1][2]
Die Farben
Das faszinierende an einem Feuerwerk sind die
unterschiedlichen Farben: Blau, Rot, Grün, Violett, Gelb, etc. Was so
schön aussieht ist teilweise sehr schwierig zu erreichen. Eine Flamme kann
man durch Zugabe von Metallsalzen wie Natrium (Gelb), Barium (Grün),
Strontium und Lithium (Rot), Kalium (Violett) und Kupfer (Blau) färben. Die Farberscheinung ist
darauf zurückzuführen, dass die Valenzelektronen der Metalle durch die
Brennerflamme in einen angeregten Zustand versetzt werden. Dieser
angeregte Zustand ist aber sehr instabil. Beim Zurückfallen auf den
Grundzustand wird der zwischen den beiden Schalen vorherrschende
Energieunterschied in Form von Lichtenergie freigesetzt.
Die
genannten Metalle sind nicht die einzigen, die Flammenfärbungen
hervorrufen können, wohl aber die gebräuchlichsten. Bei der Auswahl sollte
man aber genau wissen, welches Farbenspiel man mit einem Feuerwerk
erreichen möchte. Nimmt man eine Mischung aus
Schwefel, Kaliumnitrat, Strontiumnitrat und Natriumnitrat, so wird diese
immer gelb brennen, da das Natrium ein sehr intensives Gelb erzeugt und so
das Rot des Strontiums und das Violett des Kaliums völlig überdeckt. Gibt
man zu einer Mischung von Strontiumnitrat und Schwefel noch Magnesium
dazu, dann wird diese Mischung viel weniger rot brennen, da das Magnesium
ein sehr helles weißes Licht abgibt und so das Rot zum Teil verblasst.
Alle Farben, außer Blau, lassen sich sehr einfach erzeugen, indem man das Nitrat des entsprechenden Metalls verwendet. Der Einsatz von
Kupfernitrat erzeugt allerdings keine blaue Farbe in pyrotechnischen
Mischungen. Um Blau zu erzeugen, muss man verschiedene Kupfersalze in derselben Mischung verwenden, und genaue Mengen organischer Chlorverbindungen
zufügen, da die blaue Färbung nur dann entsteht, wenn während des Verbrennens
neben Kupfer auch Chlor vorhanden ist. In diesen Mischungen herrscht ein
feines Gleichgewicht vor, das man nicht errechnen kann. Man kann es nur
durch Versuche erreichen! [3]
Literatur:
- http://dc2.uni-bielefeld.de/dc2/gefahr/feue-was.htm,
Stand 28.08.05
- http://dc2.uni-bielefeld.de/dc2/tip/h2bild.htm,
Stand 28.08.05
- http://www.pyro-partner.de/feuerwerk/fwrk_chemie.html,
Stand 28.08.05