| Zeitbedarf: |
35 Minuten. |
| Ziel: |
Bestimmung des pKs |
| Material: |
 | Chembox |
 | Computer |
 | Leitfähigkeitssonde
|
 | pH-Meßkette
|
 | Tropfenzähler
|
 | Bürette 50ml
|
 | Stativ
|
 | 2 Bürettenhalter |
|
 | 2 Muffen, 1 Klammer |
 | Magnetrührer mit Stäbchen
|
 | Pipette 30ml
|
 | Becherglas 150ml, hohe Form
|
 | Becherglas 400ml
|
 | Magnetrührstäbchen
|
 | kleiner Trichter |
|
| |
 | Maßlösung NaOH c(NaOH)=0.1mol/l R-Sätze:
34,
S-Sätze: 26-37/39-45
E-Sätze: 2
|
|
 |
| |
 | SWIRL (Entkalker) |
|
|
| Chemikalien: |
 | dest. Wasser (Spritzflasche) |
|
|
| Vorbereitung: |
 |
-
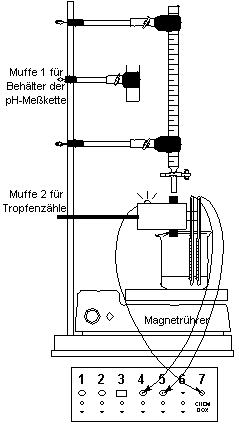
Versuch gemäß nebenstehender Skizze aufbauen.
Hinweise: Bürette für geringere Beweglichkeit mit 2^(!)
Bürettenklammern befestigen; Abstand zwischen Tropfenzähler und Becherglas
minimieren; Tropfen sollen durch die Mitte des Tropfenzähler-Rohres fallen.
-
Sicherstellen, daß die Chembox mit dem Computer verbunden
ist. Computer starten. pH-Meßkette an den pH-Eingang (4), Leitfähigkeitssonde
an den Leitfähigkeits-Eingang (5) und Tropfenzähler an Ereignis-Eingang (7)
anschließen, dann Chembox einschalten.
-
Kalibrieren Sie die
pH-Meßkette,
die
Leitfähigkeitssonde
und den
Tropfenzähler.
-
Stellen Sie im Menu Optionen - Messtakt den Punkt
Ereignis ein.
|
| Durchführung: |
Aufnahme der Titrationskurve:
-
Versuch-Symbol
oder entsprechende
CHX-Datei
anclicken.
-
In dem 150ml-Becherglas einen Rührfisch und 30ml SWIRL-Lösung vorlegen; pH-Meßkette und Leitfähigkeitssonde
eintauchen und in je eine der großen Klammern am Tropfenzähler
spannen. Falls die Meßkette oder die Sonde nicht ganz eintauchen,
nicht mit Wasser auffüllen, sondern etwas mehr Entkalker-Lösung
verwenden.
-
1/0-Knopf anklicken.
-
Bürette vorsichtig so weit aufdrehen, daß
ca. 1-2 Tropfen pro Sekunde auslaufen.
-
Wenn die Titrationskurve die gewünschte Form erreicht
hat, 1/0-Knopf wieder anclicken.
-
Kurve unter einem
Namen
im gewünschten
Arbeitsbereich
abspeichern.
-
Beschriften Sie die Kurve, z.B. "SWIRL mit NaOH c=0.1mol/l",
evtl. dazu Name des Experimentators.
-
X-Achse (Volumen) sinnvoll anpassen. Ergebnis etwa:
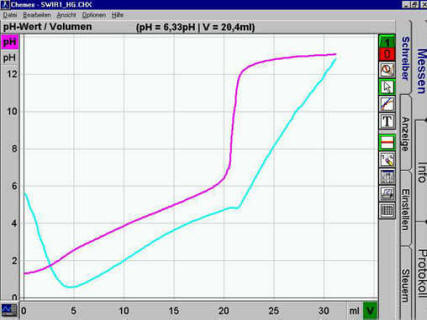
|
| Auswertung: |
Zuerst müssen die beiden Äquivalenzpunkte Äq,
anschließend die pKS-Werte durch Halbtitration berechnet
werden.
-
Insgesamt 3 beste Tangenten an die pH-Kurve im Bereich des
Umschlags bei etwa 20mL anlegen: an jeden der beiden waagrechten Abschnitte und an
den steilen Abschnitt der sigmoiden Kurve je eine.
-
Durch Positionieren des Mauszeigers zwei pH-Werte A
und B an den beiden Schnittpunkten der Tangenten ablesen (A soll der kleinere
Wert sein).
-
Der Äquivalenzpunkt Äq liegt in der Mitte
zwischen A und B:
Äq=A+((B-A)/2).
-
Notieren Sie durch Beschriften diesen Wert und den
zugehörigen Verbrauch an Natronlauge.
-
Die pH-Kurve zeigt aber noch einen weiteren Äquivalenzpunkt.
Weil dieser aber am linken Rand der pH-Kurve liegt, ist die Bestimmung an der pH-Kurve
nicht möglich. Da Sie aber zusätzlich die Leitfähigkeit aufgezeichnet
haben, ist dieser Punkt trotzdem leicht mit der 2-Geraden-Methode bestimmbar:
Sie müssen lediglich zwei beste Tangenten an der Leitfähigkeitskurve
einzeichnen. Der Schnittpunkt dieser beiden Geraden ist der andere Äquivalenzpunkt.
-
Bestimmen Sie mit dem Mauscursor auf der pH-Kurve den zum Volumen
am Schnittpunkt gehörenden pH-Wert und notieren Sie auch diesen Äquivalenzpunkt
durch Beschriften.
Damit haben Sie die beiden Äquivalenzpunkte bestimmt und müssen nun
daraus die Halbtitrationspunkte berechnen:
-
Bilden Sie den Mittelwert aus den beiden Volumina der beiden
Äquivalenzpunkte. Das Ergebnis ist der Halbtitrationspunkt.
-
Auch dieses Volumen durch Beschriften notieren.
-
Der pH-Wert, der an diesem Volumen gemessen wurde, ist einer der
gesuchten pKS-Werte.
-
Der andere Halbtitrationspunkt liegt beim halben Volumen des
linken Äquivalenzpunkts. Auch hier ist der bei diesem Volumen gemessene pH-Wert
der gesuchte pKS-Wert.
-
Abspeichern. Ergebnis etwa:
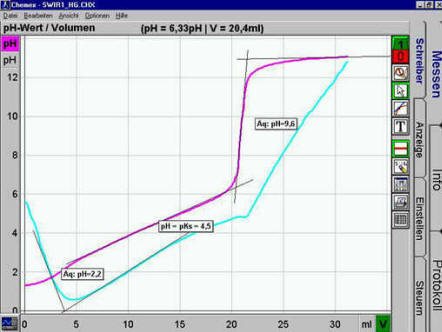
|
| Deutung: |
-
Es kommen folgende Säuren in Frage:
| Säure |
pKS 1 |
pKS 2 |
pKS 3 |
| Amidosulfonsäure |
1.05 |
|
|
| Citronensäure |
3.13 |
4.76 |
6.39 |
| Ameisensäure |
3.75 |
|
|
| Essigsäure |
4.75 |
|
|
|
| Download: |
|