| Zeitbedarf: |
40 Minuten. |
| Ziel: |
Titration von
Histidin-Dihydrochlorid mit Natronlauge zur Bestimmung des pKS. |
| Material: |
 | Chembox |
 | Computer |
 | Leitfähigkeitssonde |
 | pH-Meßkette |
 | Tropfenzähler |
 | Bürette 50ml |
 | Stativ |
 | 2 Bürettenhalter |
|
 | 2 Muffen, 1 Klammer |
 | Magnetrührer |
 | Pipette 30ml |
 | Becherglas 150ml hohe Form |
 | Becherglas 400ml |
 | Magnetrührstäbchen |
 | kleiner Trichter d=80mm |
|
| Chemikalien: |
 |
Salzsäure c(HCl)=1mol/l
R 34-37
S: 26-45
|
|
 |
Maßlösung c(NaOH)=1mol/l
R: 34 S:
26-37/39-45 |
|
|
|
 | dest. Wasser (Spritzflasche) |
|
| Vorbereitung: |
Histidindihydrochlorid herstellen: 1.94g Histidin
in 25ml c(HCl)=1mol/l auflösen |
| Aufbau:
|
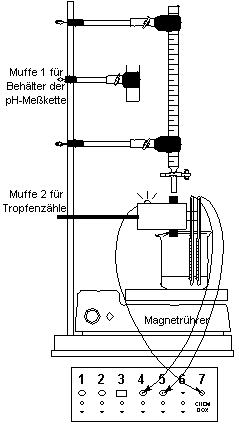 |
-
Versuch gemäß nebenstehender Skizze aufbauen.
Hinweise: Bürette für geringere Beweglichkeit mit 2 (!)
Bürettenklammern befestigen; Abstand zwischen Tropfenzähler und Becherglas
minimieren; Tropfen sollen durch die Mitte des Tropfenzähler-Rohres fallen.
-
Sicherstellen, daß die Chembox mit dem Computer verbunden
ist. Computer starten. pH-Meßkette an den pH-Eingang (4), Leitfähigkeitssonde
an den Leitfähigkeits-Eingang (5) und Tropfenzähler an Ereignis-Eingang (7)
anschließen, dann Chembox einschalten.
-
Kalibrieren Sie die
pH-Meßkette,
die
Leitfähigkeitssonde
und den
Tropfenzähler.
-
Stellen Sie im Menu Optionen - Messtakt den Punkt
Ereignis ein.
|
| Durchführung: |
-
Versuch-Symbol
oder entsprechende
CHX-Datei
anclicken.
-
In dem 150ml-Becherglas einen Rührfisch und 10ml Histidindihydrochlorid
vorlegen; Meßkette und Leitfähigkeitssonde eintauchen und in je eine
der großen Klammern am Tropfenzähler spannen. Ggf. mit Wasser so
auffüllen, daß die Meßkette und die Sonde gut eintauchen.
-
1/0-Knopf anklicken.
-
Bürette vorsichtig so weit aufdrehen, daß
ca. 1-2 Tropfen pro Sekunde auslaufen.
-
Wenn die Titrationskurve die gewünschte Form erreicht
hat, 1/0-Knopf wieder anclicken.
-
Kurve unter einem
Namen
im gewünschten
Arbeitsbereich
abspeichern.
-
Beschriften Sie die Kurve, z.B. "Histidindihydrochlorid mit NaOH c=1mol/l",
evtl. dazu Name des Experimentators.
-
X-Achse (Volumen) sinnvoll anpassen. Ergebnis etwa:
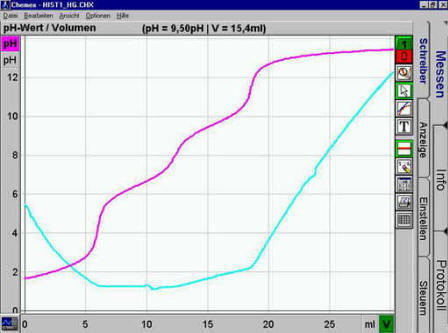
- Wieder abspeichern.
|
| Auswertung: |
Bei diesem Stoff können alle drei Äquivalenzpunkte
Äq und daraus die jeweiligen pKS-Werte durch Halbtitration berechnet
werden.
-
Insgesamt 4 beste Tangenten an die Leitfähigkeitskurve anlegen:
vor dem ersten Knick, zwischen den drei Knicken und danach je eine. D.h. jeder Knick,
also jeder Äquivalenzpunkt wird durch den Schnittpunkt zweier Tangenten genau
festgelegt.
-
Durch Positionieren des Mauszeigers an diesen Schnittpunkten der Tangenten
den Verbrauch am jeweiligen Äquivalenzpunkt ablesen und durch Beschriften notieren.
-
Das Volumen des zugehörigen Halbtitrationspunktes ist der Mittelwert
aus den Volumina dieses und des vorhergehenden Äquivalenzpunkts. Beim linken
Äquivalenzpunkt ist es der halbe Verbrauch an Natronlauge.
-
Bestimmen Sie nun mit dem Mauscursor auf der pH-Kurve die zu den errechneten
Volumina gehörenden pH-Werte. Sie sind die gesuchten drei pKS-Werte.
-
Notieren Sie diese pKS-Werte durch Beschriften.
-
Abspeichern. Ergebnis etwa:
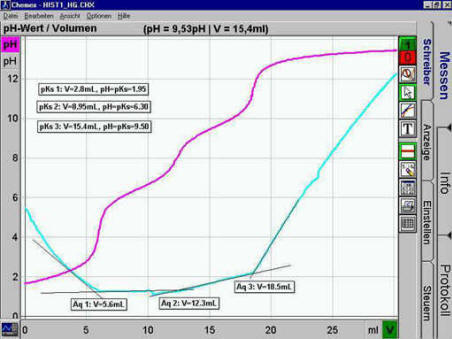 > >
- Es kommen folgende Werte in Frage:
| Säure |
pKS 1 |
pKS 2 |
pKS 3 |
| Histidindihydrochlorid |
1.82 |
6.10 |
9.17 |
|
| Deutung: |
Die pKS-Werte von
Histidin-Dihydrochlorid liegen alle in einem Bereich, der mit
Natronlauge sichtbar ist. |
| Entsorgung: |
E: 2
|
| Quelle: |
Analytik, AK Kappenberg. |
| Download: |
|
© Walter.Wagner ät uni-bayreuth.de,
Stand:
16.03.09