|
Herstellen einer
organischen Solarzelle
(Grätzel-Zelle)
Erklärung
|
L |
Herkömmlichen Solarzellen bestehen im
Wesentlichen aus Silizium: es liefert bei Sonneneinstrahlung die Elektronen und
diese können, dank der elektrischen Leitfähigkeit von Silizium, zu den
Elektroden fließen.
In der Grätzel-Zelle gibt es für die beiden
Aufgaben zwei verschiedene Stoffe:
-
ein (organischer) Farbstoff liefert bei
Lichteinstrahlung die Elektronen und
-
Titandioxid leitet sie zu den Elektroden.
Erklärungsebene Jgst. 5-11:
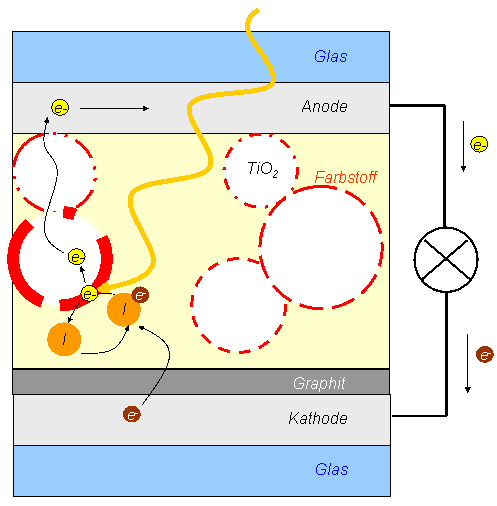
Abb. 1: Schematischer Weg der
Elektronen
schnelle Animation (PowerPoint
XP erforderlich: ppt 4,5M
schrittweise Animation (PowerPoint XP erforderlich: ppt
4,5M
Erklärungsebene Jgst. 12-13:
Durch die Absorption eines Photons wird aus dem
Farbstoffmolekül ein Elektron freigesetzt und durch das elektrisch leitende Titandioxid zur Anode abgeführt.
Nun muss dafür
gesorgt werden, dass die Elektronen auf ihrem Weg nicht wieder zu den
ionisierten Farbstoff-Molekülen „umkehren“, da es dann keinen Stromfluss geben
würde. Aus diesem Grunde fügt man einen Elektrolyten bei, der dem Farbstoffkation schnell ein Ersatzelektron nachliefert, hier
Iod-Kaliumiodid-Lösung.
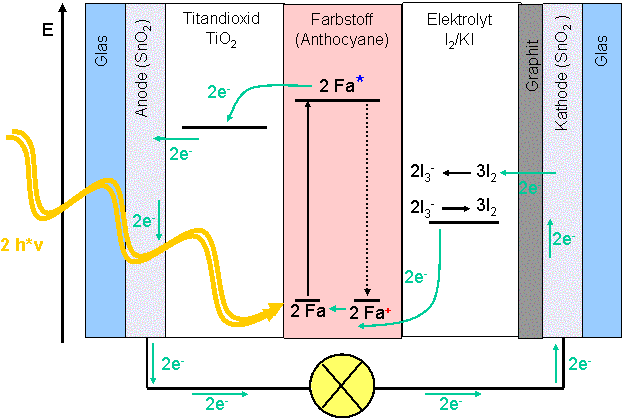
Abb. 2: Redox-Vorgänge und
Schichtenaufbau
Animation (PowerPoint XP erforderlich: ppt 4,5M
In Schritten:
-
Durch einfallende Lichtstrahlen (Quanten) werden in den
Farbstoff-Molekülen Fa Elektronen energetisch angeregt und durch deren Energie auf ein höheres
Energieniveau gebracht.
Fa + hv --> Fa*
-
Da sich das Energieniveau oberhalb der Leitungsbandes
von
Titandioxid befindet, kann das Elektron übertreten (ein wenig "herunterfallen"):
aus dem angeregten Zustand der
Farbstoff-Moleküle werden die Elektronen auf das Leitungsband des Titandioxids
übertragen.
Ox.: Fa* --> Faox + e-
Leitung: TiO2 + e- --> TiO2-
TiO2-
--> TiO2 + e-
Dieser Ladungsinjektion entgegen stehen Deaktivierungsprozesse. Mit ausgewählten Farbstoffen
erzielt man heute bereits Ausbeuten von etwa 90 %.
-
Aus der Anode fließen die Elektronen über den
Verbraucher, der die zugeführte Energie "verbraucht" (eigentlich: umwandelt),
zur Kathode.
-
Die Kathode führt diese Elektronen dem System
zurück. Nur deshalb bleibt der Elektronenfluss aufrecht. Zunächst wird der Elektronenverlust des Farbstoffs
aus dem Iodid der
Elektrolyt-Lösung ausgeglichen, indem es zu Triiodid reduziert wird.
Ox.: 3 I- --> I3- + 2e-
Red.:
2 Faox + 2e- --> 2 Fa
-
Dann wird das Iodid mit Hilfe der Elektronen aus
der Kathode zurückgebildet:
I3- + 2 e- --> 3 I-
Das System befindet sich wieder in der Ausgangslage.
© Walter.Wagner ät uni-bayreuth.de
|

