Antwort von Dr. W. Milius, Anorganische Chemie:Wichtig ist,
dass man im Fall des Mangans zwei verschiedene Redoxsysteme,
eines im
basischen und eines im sauren Medium vor sich hat.
 [2]
[2]
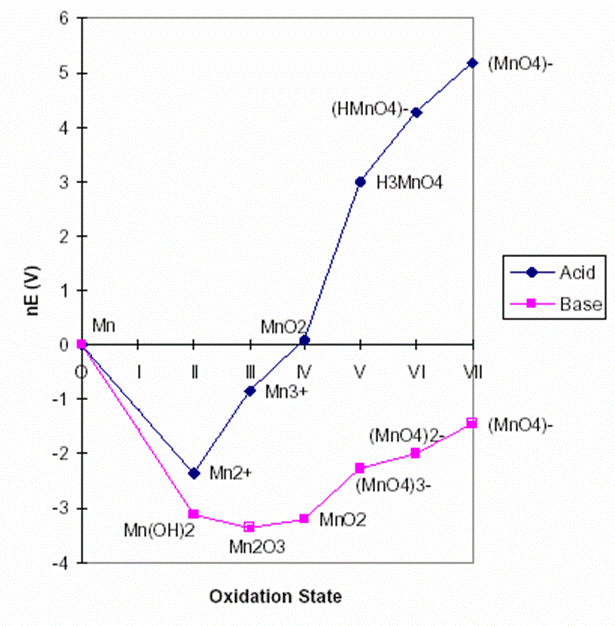
Wie aus obigem Frost-Diagramm (hier liegen alle Normalpotentiale
der Einzelreaktionen zugrunde, siehe Lit. [1]) zu entnehmen ist, endet die
Reduktion im sauren Medium bei Mn2+ (Minimum der Kurve),
im basischen Medium bei Mn2O3 - nahezu
gleichauf mit MnO2.
Das MnO2 ist ein leichtes Oxidationsmittel gegenüber dem
Mn3+, oxidiert er zu MnO2 und da das MnO2
als fester Braunstein aus dem Gleichgewicht verschwindet, wird als
Produkt dieser Reaktion nur MnO2 zurückbleiben.
Literatur:
-
http://www.ias.tuwien.ac.at/student/download/downloads/AllgChem08_Redox.pdf
-
http://classes.uleth.ca/200501/chem2810a/lecture_20.pdf
24.11.2006