| Frage: Im
Chemieunterricht der Jahrgangsstufe 11
bespricht man in Bayern die Übergangselemente.
Ihre Einordnung in das PSE wird damit
begründet, dass die energetische Reihenfolge
der Teilschalen folgendermaßen lautet:
4 s, 3 d, 4 p ... Im Kästchenmodell
füllt man die Elektronen dann auch in dieser
Reihenfolge ein. Nun ergeben sich bei der
Besprechung der Ionen dieser Elemente und bei den
Komplexverbindungen folgende Probleme:
1. Ich betrachte z.B. Zn2+-Ionen.
Bei der Bildung dieser Ionen werden zwei
Valenzelektronen abgeben. Seltsamerweise entnimmt man diese dem
energetisch tieferen 4s-Orbital und nicht den 3
d-AO. Warum?
Ähnliche Frage: Das Eisenatom hat die Elektronenkonfiguration (Ar)
4s2 3d6. Beim Eisen(II)-ion geben
Schulbücher die Konfiguration 4s0 3d6 an. Des
weiteren wird angegeben, dass halb- und vollbesetzte Unterschalen
wie p3 und d5 energetisch besonders stabil
seien. Warum hat dann das Eisen(II)-ion nicht die Konfiguration 4s1
3d5?
2. In ähnlicher Weise habe ich
Erklärungsschwierigkeiten bei der Darstellung
der Elektronenkonfiguration von z.B. einem
Hexaquaeisen(III)-Komplex. Wieder geht es um das
Kästchenmodell. Warum füllt man die
Elektronen der Liganden nicht nach dem Energiegehalt der Teilschalen
in die entsprechenden Orbitale,
also zuerst ein Paar in das 4 s-AO, dann drei Paare in die drei
4 p-AO, dann ein Paar in
das 5 s-AO und schließlich ein Paar in ein 4
d-AO? In vielen Schulbüchern werden die
Elektronenpaare 5 und 6 in zwei 4 d-AO
gefüllt. Warum verstößt man hier auch wieder gegen die
energetische Reihenfolge der Teilschalen
bzw. Orbitale?
| Antwort 1 von Prof. Peter
Morys und Prof. Jürgen Senker, Anorganische Chemie I. |
Zu Frage 1:
Die Elektronen der Valenzschale eines Atoms oder Atomions
unterliegen im wesentlichen zwei
gegenläufigen Krafteinwirkungen: Zum einen
unterliegen sie der elektrostatischen
Anziehung durch den Atomkern bzw. den
Atomionenrumpf (Atomkern zzgl. die diesen in seiner
Anziehungskraft abschirmenden
Rumpfelektronen) sowie der abstoßenden elektrostatischen
Wechselwirkung der Elektronen untereinander. Während die
vom Atomkern ausgehende anziehende
Wechselwirkung zu einer energetischen Anordnung
der Valenzorbitale des Atoms führt,
bei der die Orbitale gleicher
Hauptquantenzahl dicht beieinander zu liegen kommen (siehe das
H-Atom, bei dem die
Atomorbitale gleicher Hauptquantenzahl völlig identische
Orbitalenergien aufweisen), führt die interelektronische
Wechselwirkung eher zu einer
Energiedifferenzierung der Orbitale gleicher
Hauptquantenzahl derart, dass
E(ns) < E(np) < E(nd) wird. Der Grund hierfür ist in der
unterschiedlichen Aufenthaltswahrscheinlichkeit der
Elektronen verschiedener Nebenquantenzahl
zu sehen: Die Aufenthaltswahrscheinlichkeit
der s-Elektronen ist kernnäher als die der p-Elektronen,
und die der p-Elektronen wiederum kernnäher
als die der d-Elektronen. Die s-Elektronen
der Valenzschale tauchen daher tiefer in die
Rumpfelektronenschalen ein als
die Elektronen auf den Hauptquantenzahl-gleichen
p-Orbitalen, erfahren dabei eine höhere
effektive Kernladungszahl und bewegen sich mithin auf
einem negativeren, d. h. energetisch
stabileren Energieniveau als diese. Noch
weniger tief tauchen die d-Elektronen auf ihren Orbitalen in die
Rumpfelektronenschalen ein, weswegen sie die
vergleichsweise höchsten Energiewerte
aufweisen. Auf diese Weise kommt es infolge
der interelektronischen Wechselwirkung
dazu, dass das 4s-Elektronen-Niveau in
einem neutralen Übergangsmetallatom
energetisch tiefer zu liegen kommt als das 3d-Niveau dieses
Atoms (Abb. 1a). Diese Aufeinanderfolge von Unterniveaus wird
gerne so gelernt, gilt aber nur für das neutrale Atom.
Es ist unzulässig, diese Erkenntnis zu
verallgemeinern. Begründung:Nimmt man Elektronen aus
dem Atom heraus, reduziert sich die Abstoßung der Elektronen und
die Orbitale kontrahieren. Dabei kontrahieren z.B. die
3d-Orbitale stärker und rutschen energetisch gesehen unter die
4s-Orbitale. Aus diesem Grund gibt es bei Metallionen der
Übergangsmetalle keine s-Valenzelektronen mehr. Das gilt
praktisch für alle zwei- und höherwertigen Metallionen, nur bei
einfach geladenen Ionen gibt es gelegentlich Ausnahmen (Abb.
1b). Leider fehlt in Schulbüchern jeglicher
Hinweis auf diesen Zusammenhang, so dass
(schulbuchinduzierte) Lernschwierigkeiten
vorprogrammiert sind.
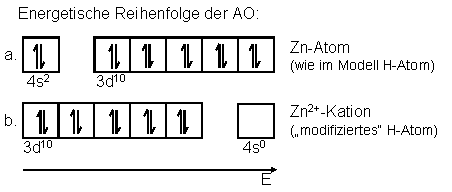
Abb. 1: Zn-Atom und Zn2+-Kation
Zu Frage 2:
Das hier beschriebene Kästchenmodell entspricht der
VB-theoretischen Sichtweise der Komplexbildung und -bindung von
Linus Pauling. Dieses Valenzbindungsmodell wurde - im Hinblick auf
eine deutlich wirklichkeitsnähere Beschreibung der
Bindungsverhältnisse in Übergangsmetallkomplexen mit Hilfe der
Molekül-Orbital-Theorie (MO-Theorie) - schon seit einiger Zeit
aufgegeben. Eine VB-theoretische Beschreibung leidet gegenüber
einer entsprechenden MO-theoretischen Behandlung eines Übergangsmetall-Komplexes
unter dem Fehlen der an sich vorhandenen antibindenden MO-Orbitale
innerhalb des Komplexes, welche sich aus der Kombination von
Metall- und Ligandenorbitalen neben den bindenden Orbitalen
zusätzlich ergeben. Dadurch müssen in einer VB-theoretischen
Behandlung eines Übergangsmetall-Komplexes
"künstlich" energetisch hoch liegende Orbitale besetzt werden, die
in Wirklichkeit gar nicht besetzt werden. - Für die energetische
Reihenfolge der Atomorbitale des im allgemeinen kationischen
Zentralatoms in einem Übergangsmetall-Komplex
gelten im übrigen die unter Punkt 1 genannten Gesichtspunkte
(Reihenfolge der Atomorbitale etwa wie in einem modifizierten
H-Atom).
|
|
| Antwort 2 von Prof. Max
Herberhold, Lehrstuhl für Anorganische Chemie II. |
Den Widersprüchen liegen gleich zwei
Probleme zugrunde:
 | Die Kästchenschreibweise ist eine einfache
Möglichkeit, die Elektronenkonfiguration bei Atomen nach dem
VB-Modell zu notieren. Die Leistungsfähigkeit der Schreibweise
ist mit den hier vorliegenden Anforderungen überschritten. |
 | Zur Erklärung von Elektronenkonfigurationen bei
Übergangsmetallkomplexen werden mehrere verschiedene Modelle
herangezogen, z.B. VB-, Ligandenfeld- und MO-Theorie. Es muss klar
sein, wo die Grenzen der Modelle liegen und wann welches der Modelle
angewandt wird. |
Zu Frage 1:
Die Kästchenschreibweise gibt innerhalb der
VB-Methode die Elektronenkonfiguration der Metallatome
korrekt wider (Abb. a), obwohl es auch schon da Ausnahmen von der
Regel gibt, die mit der besonderen Stabilität halb- und vollbesetzter
Schalen zusammen hängen (etwa Cr: 4s1d5). Im
freien Ion (Abb. b) sind die d-Orbitale tatsächlich alle energiegleich
und geringfügig höher liegend als die s-Orbitale des gleichen Niveaus.
Für Ionen liegen die Verhältnisse dann anders, wenn man die
Einflüsse der Umgebung nicht mehr vernachlässigt. Die
Ligandenfeld-Theorie kommt ins Spiel, d.h. die
Elektronenbesetzung im Metall-Kation hängt von der Zahl und Stärke der
Liganden ab. Nähern sich die Liganden dem Metall-Kation, sind die
d-Orbitale nicht mehr äquivalent, sondern spalten in zwei Gruppen aus
2 bzw. 3 Orbitalen auf, von denen je nach Ligand die eine energetisch
günstiger, die andere dafür ungünstiger liegt. Die Valenzelektronen
(4s und 3d) verteilen sich je nach äußeren Gegebenheiten
unterschiedlich. (Abb. c und d)
Dieser Effekt ist vergleichbar mit der Betrachtung des C-Atoms: für
das freie C-Atom formuliert man s- und p-Orbitale, für das gebundene
hingegen Hybridorbitale, je nach Fall sp3, sp2
oder sp - was zu unterschiedlichen Geometrien führt. Das gilt auch für
das Zn2+. Je nach Ligand hat es tatsächlich mehrere
Möglichkeiten: [Zn(CN)4]2+ ist tetraedrisch
gebaut (sp3), [Zn(H2O)6]2+
oktaedrisch (d2sp3), [Zn(Gly)2]
quadratisch-planar (dsp2). Hier tauchen also "vermischte"
Orbitale aus 3d, 4s und 4p auf, womit man allerdings den
Kenntnisbereich von Schülern einer Jgst. 11 verlässt. Solche
Hybridorbitale lassen sich in der Kästchenschreibweise entweder nicht
darstellen oder, wenn man es doch macht, dann sind die Kästchen eben
gleich, so dass die Frage, ob die Elektronen aus dem s- oder d-Orbital
stammen, überflüssig ist.
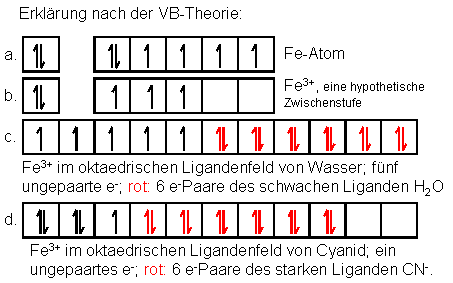
Abb. 2: Fe-Atom und Fe3+-Kation in
unterschiedlichen Umgebungen.
Zu Frage 2:
Sehr ähnlich gestaltet sich die Antwort auch bezüglich [Fe(H2O)6]3+.
Fe3+ ist nicht mehr frei, sondern wird im Ligandenfeld von
6 Wassermolekülen beeinflusst. Diese sind schwache Liganden, können
also die fünf d-Elektronen gleichen Spins nicht zur Paarung (und somit
teilweisen Spinumkehr) zwingen. 4s, 4p und zwei Orbitale aus 3d werden
durch je zwei Elektronen des Wassers besetzt - das ergibt die
Komplexbindung - und einen Teil der Begründung, warum 4s nicht mehr
für die Elektronen des Eisens zur Verfügung steht. Der andere Teil der
Begründung würde Grundlagen aus der MO-Theorie und
Symmetriebetrachtungen erfordern, die auch Studenten im Grundstudium
überfordern. |

Chemie / Universität Bayreuth

E-Mail: Walter.Wagner ät uni-bayreuth.de
|